Amidas
- 1220
- 171
- Arthur Terry II
Selitämme, mitkä niiden ominaisuudet, rakenne, tyypit, nimikkeistö ja annamme useita esimerkkejä
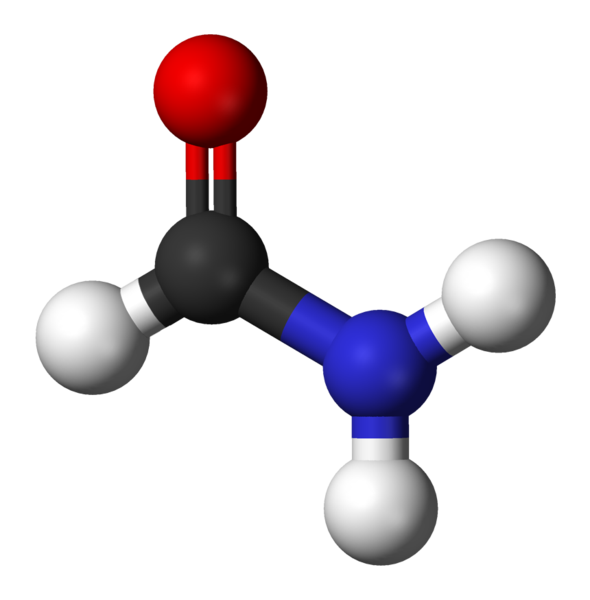
 Formamidi, yksinkertaisin amida
Formamidi, yksinkertaisin amida Mitkä ovat amidat?
Amidas ovat eräänlainen orgaaniset yhdisteet, jotka muodostuvat karboksyylihapon ja amiinin välisellä unionilla. Niitä kutsutaan myös happamiksi amiiniksi ja sieltä on juuri mistä sana tulee amidi.
Nämä yhdisteet ovat erittäin tärkeitä elämälle, koska ne ovat olennainen osa proteiineja, peptidejä ja joitain hormoneja. Ne ovat myös osa DNA: n ja RNA: n typpipohjaa, jotka sisältävät geneettisen tietomme.
Amidas ovat myös erittäin tärkeitä teollisuudessa. Esimerkiksi, Nylon Se on yksi käytetyimmistä synteettisistä kuiduista ympäri maailmaa, ja se muodostuu pitkällä yhdistyneiden amidien ketjulla peräkkäin.
Lisäksi amideja käytetään paljon lääketeollisuudessa, koska ne ovat osa lääkkeitä, kuten lidokaiinia.
Amidien ominaisuudet
- Lähes kaikki ovat vankkoja: Kaikki amidit ovat kiinteitä huoneenlämpötilassa, paitsi pienin ja yksinkertaisin, joka on formamidi. Jälkimmäinen on neste.
- Heillä on korkea kiehumispiste: Verrattuna karboksyylihapoihin ja amiiniin, joista ne valmistetaan, amidit ovat korkea kiehumispiste. Esimerkiksi asetamidi (valitse3Conh2) Se muodostuu etikkahappon (etikka) liitoksi ammoniakkiin. Asetamidin kiehumispiste on 221,2 ºC, kun taas etikkahappo on 118 ºC ja ammoniakki on -33,34 ºC.
- Jotkut ovat vesiliukoisia: Pienin amidas sekoittuu hyvin veden kanssa, joten se on helppo liuottaa. Kuitenkin, kun heistä tulee isompia, heistä tulee vähemmän liukoisia.
- Ne ovat vähemmän yksinkertaisia kuin amiinit: AMIDA on aina vähemmän emäksinen (tai enemmän hapan) kuin amiinia, josta se tulee. Itse asiassa nimi Amida tulee yhdistämisestä minäNa+ACIantaa.
- Linkkisi on helposti rikki: Jos lisätään vahva emäs katalysaattorina, amidit reagoivat nopeasti veden kanssa. Tätä reaktiota kutsutaan hydrolyysiksi ja saman aikana AMIDA rikkoutuu alkuperäisen hapon ja amiinin muodostamiseksi.
- Ne ovat värittömiä ja wc: Yleensä amidit ovat aineita, joilla ei ole väriä tai tyypillistä hajua.
Funktionaalinen ryhmärakenne
Kemiallisesti AMIDA on funktionaalinen ryhmä, joka sisältää karbonyyliryhmän (C = O) karboksyylihaposta, joka on kytketty typeen ammoniakista tai amiinista. Amidien yleinen rakenne on:
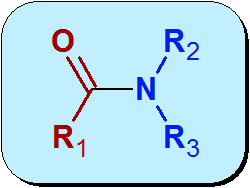 Edellisen kuvan molekyylin punainen osa on peräisin karboksyylihaposta ja sitä kutsutaan Asyyli. Sininen osa tulee Amidasta.
Edellisen kuvan molekyylin punainen osa on peräisin karboksyylihaposta ja sitä kutsutaan Asyyli. Sininen osa tulee Amidasta.
Niitä erottavien amiinista erottavien keskellä olevien rakenteen ominaisuus on, että typpi omistaa sen karbonyyliryhmän kanssa resonanssiprosessin kautta. Tämä tekee keskelle vähemmän perustiedot kuin amiinit.
Amidityypit
Riippuen siitä, yhdistetäänkö happo ammoniakkiin, primaarisen aminan kanssa vai sekundaariseen amiiniin, voidaan saada kolmen tyyppisiä amideja, joilla on erilaisia rakenteita:
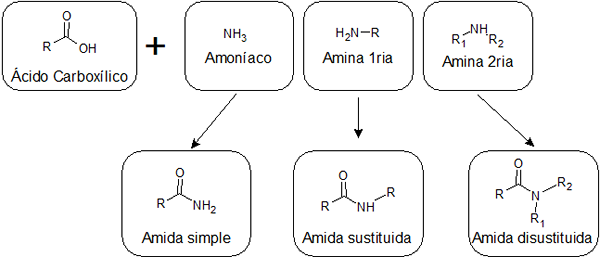
Yksinkertainen amides
Ne muodostetaan karboksyylihapon ja ammoniakin välinen liitto. Tämän tyyppisellä amidalla on ryhmä -nh2 Linkitetty karbonyyliryhmään. Yksinkertaiset amidit voivat muodostaa useita vety sidoksia toisiinsa ja vedellä, joten ne ovat yleensä liukoisempia kuin korvattu.
- Yksinkertaisia Amida -esimerkkejä: formamidi, asetamidi ja butyramidi.
Korvattu amidit
Ne saadaan hapon ja primaarisen amiinin yhdistämällä. Tässä tapauksessa yksi -nh -hydrogeneista2 Yksinkertaisista amideista korvataan alkyylillä, ja siksi heille kerrotaan.
- Esimerkki vaihdetusta amidista: Proteiinien aminohappojen välinen yhteys.
Hylättyjä amideja
Ne tulevat hapon ja toissijaisen amiinin välisestä reaktiosta. Tässä tapauksessa ryhmän molemmat hydrogens -nhh2 Ne korvataan alkyyliryhmillä. Eristyneiden amidien ei ole vetyä nitrogeeneihin, joten ne eivät voi muodostaa vety silloja toistensa kanssa, ja vain yksi heikko vedellä. Tämä tekee niistä vähemmän liukenevia veteen kuin muut amidit.
Laktaamat, ensisijainen, toissijainen ja tertiäärinen amidas
Uusien äskettäin mainittujen amidien lisäksi on myös Ensisijainen, toissijainen ja tertiäärinen amidi, Se eroavat siitä, että yksi, kaksi tai kolme happamaa ryhmää yhdistyi typpiatomiin.
Lopuksi jotkut amidimuodostavat suljetut syklit. Tässä tapauksessa yhdistettä kutsutaan laktami. Laktamaat ovat luonteeltaan erittäin tärkeitä. Esimerkiksi Urasiili, joka on osa RNA: ta, on laktami.
Amidasin nimikkeistö
Yksinkertainen amides
Yksinkertaiset amidit on nimetty sen hapon hiiliketjun nimestä, josta ne tulevat (pääketju). Nimi on rakennettu asettamalla etuliite, joka osoittaa hiilihiilien lukumäärän (metan-, butan-, heksaan- jne.) tai hapon yleinen nimi poistamalla pääte -OICO tai -co (kuten acétICO) Ja lopettamisen lisääminen -AMIDA.
- Esimerkki: Amidia, joka tulee etikkahaposta, kutsutaan asetamidiksi ja sitä, joka tulee propanóiinihaposta, kutsutaan propanamidiksi.
Korvattu ja epävarma amidit
Tässä tapauksessa se alkaa nimittämällä alkyyliryhmät, jotka yhdistyvät typeen, edeltävän kirjain N-. Sitten loput amidasta kutsutaan pääketjuksi.
Se voi palvella sinua: rikki: historia, ominaisuudet, rakenne, hankkiminen, käyttöEsimerkki:
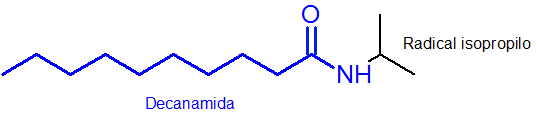 Kuten voidaan nähdä, typeen kiinnitetty substituentti on isopropyyliryhmä, joten se sisältyy nimeen N-Osopropyylinä (viimeinen “O” poistetaan aina radikaalin nimeen).
Kuten voidaan nähdä, typeen kiinnitetty substituentti on isopropyyliryhmä, joten se sisältyy nimeen N-Osopropyylinä (viimeinen “O” poistetaan aina radikaalin nimeen).
Muilla pääketjussa, jolla on AMIDA -funktionaalinen ryhmä, on 10 hiiliatomia. Eli nimesi on oltava etuliite, jota seuraa amida-irtisanominen tai, dekanamidi. Joten hän Koko nimi on n-osopropildekanamidi.
Esimerkkejä amideista
- Bentsamidi C6H5Conh2
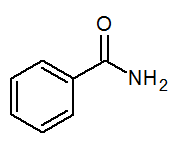
- N, N-dimetyyliasetamidi CH3Kanssa (ch3-A2
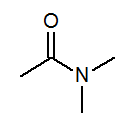
- Asetamidi CH3Conh2
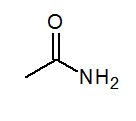
- Fenyyliasetamidi (C6H5) Ch2Conh2
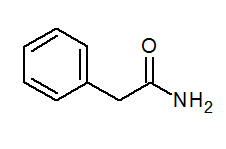
- N-butil-n-propilformamide hcon (c3H7) (C4H9-A
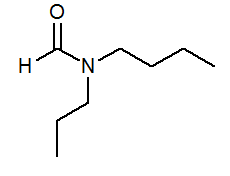
- 4-hydroksybanamidi CH2(Voi) Cho2CH2Conh2
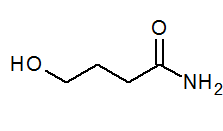
- Urea co (NH2-A2
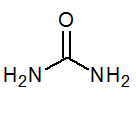
- Propanamidi ch3CH2Conh3
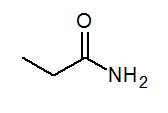
- N-butil-2-eChopilpetinamida ch3CH2CH2CH (c3H7) Conh (c4H9-A

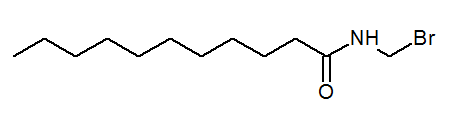
- N- (bromometyyli) un-ecanamidi CHO3(CH2-A9Conhch2Br
Viitteet
- Britannica, t. Encyclopaedian toimittajat (2019, 15. toukokuuta). Amidi. Britannica Encyclopedia. Otettu Britannicasta.com
- Amisit ja nimet. (2020, 17. elokuuta). Otettu kemista.Librettexts.org
- Carey, f. -Lla. (2008). Orgaaninen kemia. Boston: McGraw-Hillin korkeakoulu.
- Smith, m., Maaliskuu, J., & Maaliskuu, J. (2001). Maaliskuun edistyksellinen orgaaninen kemia: reaktiot, mekanismit ja strupture. New York: Wiley.
- Zabicky, J. (1970). AMIS: n kemia, osa 1. New York: Wiley

