Antimonihistoria, rakenne, ominaisuudet, käytöt ja riskit

- 2056
- 361
- Sheldon Kuhn
Hän antimoni Se on kiiltävä, hopea metalloidi ja tietyllä sinisellä sävyllä. Sen kiinteälle on myös ominaista olla erittäin hauras ja okastettu rakenne. Se kuuluu jaksollisen taulukon ryhmään 15, jota johtaa typen. Vismutin (ja moskovan) jälkeen se on ryhmän raskain elementti.
Sitä edustaa SB -kemiallinen symboli. Luonnossa sitä löytyy pääasiassa Stabit- ja Ullmannite -mineraaleista, joiden kemialliset kaavat ovat SB2S3 ja vastaavasti NISB: t. Sen korkea taipumus muodostaa sulfideja oksidien sijasta, koska se on kemiallisesti pehmeä.
 Kiteinen antimoni. Lähde: Paras sci-rasva [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Kiteinen antimoni. Lähde: Paras sci-rasva [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Toisaalta antimoni on myös fyysisesti pehmeä, ja se esittelee 3 kovuus MOHS -asteikolla. Se on vakaa huoneenlämpötilassa eikä reagoi ilman hapen kanssa. Mutta kuumennettuna hapen läsnä ollessa, hän muodostaa antimonitrioksidin, SB2JOMPIKUMPI3.
Se on myös kestävä heikkojen happojen vaikutukselle; Mutta typpihapot hyökkäävät kuumaan.
Antimonissa on lukuisia sovelluksia, joista on käytetty leveysleeoksia, joilla on lyijy ja tina, akkujen, alhaisen kitkamateriaalin jne. Akkujen valmistuksessa, jne.
Tällä metalloidilla on harvinainen omistettu määrän lisäämiseksi jähmettyessään, jolloin seokset voivat kokonaan käyttää tilaa, jota käytetään valmistaa instrumentin muokkaamiseen.
[TOC]
Löytösi historia
BC
On todisteita siitä, että vuodesta 3100.C, antimon -sulfidia käytettiin kosmeettina Egyptissä. Mesopotamiassa, nykyisessä Irakissa, maljakon jäännökset ja toinen esine havaittiin, että väitettiin olevan välillä 3000 - 2200 vuotta.C, jossa sitä käytettiin sen antimonikeskukseen.
Termin käyttöönotto
Roman Erúdito Plinio El Viejo (23-79 D.c) kuvasi antimonin käyttöä, jota hän kutsui Estibioksi, seitsemän lääkkeen kehittämisessä hänen luonnonhistoriallisessa sopimuksessaan. Alkemisti Abu Mussa Jahir Ibn Hayyan (721-815) johtuu termin antimonin käyttöönotosta elementin nimittämiseksi.
Hän käytti seuraavaa etymologiaa: 'anti' synonyyminä kieltäytymiselle ja 'mono' vain. Sitten hän halusi korostaa, että antimoni ei ollut yksin luonnossa. On jo tiedossa, että se on osa rikimineraaleja, jotka kuten muut elementit.
Saada
Kreikkalaisen natristisen Pedanius -diassoridien uskotaan saavan puhdasta antimonia lämmittämällä antimonisulfidia ilmavirrassa. Italialainen metallurginen Vannocio Biringucio, pyrotekniikan kirjassa (1540), kuvaa menetelmää antimonin eristämiseksi.
Saksalainen kemisti Andreas Libavius (1615) käyttämällä valettua rautaa, antimonisulfidia, suolaa ja kalium -tartratoa, saavutti kiteisen antimonin tuotannon.
Ensimmäisen yksityiskohtaisen raportin antimonista teki vuonna 1707 ranskalainen kemisti Nicolas Lemery (1645-1715), hänen kirjassaan käsiteltynä antimonilla.
Voi palvella sinua: kuparikloridi (i) (cucl): rakenne, ominaisuudet, käyttötarkoituksetAntimonirakenne
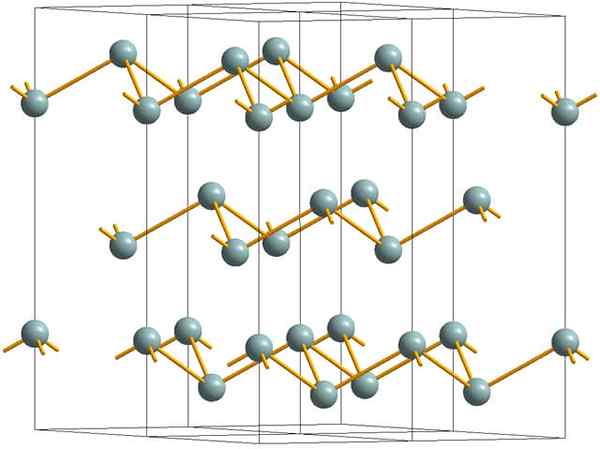 Ryppyiset kerrokset, jotka muodostavat metallisen tai hopea -antimonin kiteisen rakenteen. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Ryppyiset kerrokset, jotka muodostavat metallisen tai hopea -antimonin kiteisen rakenteen. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Yläkuva näyttää arseeniatomien käyttämien ryppyisten kerrosten rakenteen. Harmahtavan antimonia, joka tunnetaan paremmin nimellä metallinen antimoni, myös omaksuu tämän rakenteen. Sanotaan.
Nämä kerrokset, vaikka ne ovat vastuussa fotoneista, jotka ovat sen kanssa vuorovaikutuksessa hopeakeilojen loistamiseksi, mikä tekee antimonista metallia, totuus on, että ne yhdistävät voimat ovat heikkoja; Täältä voidaan näyttää helposti SB: n näennäisiin metallifragmentteihin ja ovat hauraita tai lenkkarit.
Lisäksi ryppyisissä kerroksissa olevissa SB.
Nähdään harmahtavan pallon erikseen, voit nähdä, että siinä on kolme SB-SB-linkkiä. Korkeammasta tasosta SB voitiin nähdä kolmion keskellä, ja sen kärjessä kolme SB: tä. Kolmio ei kuitenkaan ole tasainen ja siinä on kaksi tasoa tai lattiaa.
Tällaisten kolmioiden ja niiden linkkien sivuttaiskerros on ryppyiset kerrokset, jotka ovat kohdistettuja rombobisiksi kiteisiin.
Allotropia
Äskettäin kuvattu rakenne vastaa harmahtavaa antimonia, joka on vakain sen neljästä alotrooppista. Kolme muuta alotrooppia (musta, keltainen ja räjähdys) ovat metastabiilia; Eli ne voivat olla olemassa hyvin tiukaissa olosuhteissa.
Sen rakenteista ei ole liikaa tietoa. On kuitenkin tiedossa, että musta antimoni on amorfinen, joten sen rakenne on sotkuinen ja monimutkainen.
Keltainen antimoni on vakaa alle -90ºC, se käyttäytyy ei -metallisesta elementtinä ja voidaan arvelua, joka koostuu pienistä SB -agglomeraateista4 (samanlainen kuin fosfori); Lämmitettäessä se muuttuu mustaksi alotropeiksi.
Ja räjähtävän antimonin suhteen se koostuu katodiin muodostetusta gelatiinisisäiliöstä antimonihalogenin vesiliuoksen elektrolyysin aikana.
Pienintäkään vahvaa rubbia.
Ominaisuudet
Atomipaino
121,76 g/mol.
Atominumero
51.
Elektroninen kokoonpano
[KR] 4d105s25 p3.
Hapetustilat
-3, -2, -1, +1, +2, +3, +4, +5.
Fyysinen kuvaus
Kiiltävä hopea, hauras, oksas pinta, sinisellä sävyllä. Se voi myös näkyä mustana pölynä.
Sulamispiste
630,63 ºC.
Kiehumispiste
1.635 ºC.
Tiheys
-6 697 g/cm3 huonelämpötilassa.
-6,53 g/cm3 Nestemäisessä tilassa lämpötila, joka on yhtä suuri tai suurempi kuin sulatuspiste.
Sulamislämpö
19,79 kJ/mol.
Höyrystyslämpö
193,43 kJ/mol.
Voi palvella sinua: kuparisulfidi: rakenne, ominaisuudet, käytötMolaarinen kalorikapasiteetti
25,23 j/mol.K -k -
Elektronegatiivisuus
2.05 (Pauling -asteikko).
Atomiradio
140.
Kovuus
Se on pehmeä elementti, jonka kovuus 3 mohs -asteikolla ja sitä voidaan raaputtaa lasilla.
Vakaus
Se on vakaa huoneenlämpötilassa, ei kokenut hapettumista. Se on myös resistentti happohyökkäykselle.
Isotoopit
Siinä on kaksi vakaa isotooppia: 121SB ja 123SB. Lisäksi radioaktiivisia isotooppeja on 35. Radioaktiivinen isotooppi 125SB on se, jolla on suurin puoli -elämä: 2,75 vuotta. Yleensä radioaktiiviset isotoopit säteilevät β -säteilyä+ ja β-.
Sähkö- ja lämmönjohtavuus
Antimony on huono lämmön ja sähkön johdin.
Kemiallinen reaktiivisuus
Vety ei voi syrjäyttää laimennettuja happoja. Ioninen kompleksi muodostuu orgaanisten ja epäorgaanisten hapojen kanssa. Metallinen antimoni ei reagoi ilman kanssa, mutta se muunnetaan nopeasti oksidiksi märkäksi ilmaan.
Halogeenit ja sulfidit hapettelevat antimonin helposti, jos prosessi tapahtuu korkeissa lämpötiloissa.
Sovellukset
Seokset
Antimonia käytetään seoksessa lyijyn kanssa lautasten laatimiseksi autoparistojen parantamiseksi, lautasten vastustuskyvyn parantamiseksi sekä kuormien ominaisuuksien suhteen.
Lyijy- ja tina -seosta on käytetty parantamaan hitsien ominaisuuksia, samoin kuin merkkiaineiden ja patruunoiden ominaisuuksia. Sitä käytetään myös seoksissa sähkökaapelin päällysteessä.
Antimonia käytetään antifrifiktioseoksissa, kuorien ja kovettuvien seosten valmistuksessa, joilla on vähän tinapitoisuutta elimien ja muiden soittimien valmistuksessa.
Se esittelee veden kanssa jaetun ominaisuuden, joka on lisääntynyt tilavuudella; Joten seoksissa esiintyvä antimoni lyijy ja tina, täyttää kaikki muottien tilat parantaen näillä seoksilla tehtyjen rakenteiden määritelmää.
Palonestoaine
Antimonitrioksidia käytetään Igniphed -yhdisteiden kehittämiseen, aina yhdessä halogenoitujen palonestoaineiden, bromien ja kloridin kanssa.
Palon hidastimet voivat reagoida happea ja radikaalien atomien kanssa OH, joka estää tulta. Näitä igniphedejä käytetään lasten, lelujen, lentokoneiden ja turvaistuimien vaatteissa.
Niitä lisätään myös polyesterihartseihin ja lasikuitukokoonpanoihin käytettyihin esineisiin, kuten kevyisiin lentokoneiden moottorit.
Antimoniyhdisteitä, joita käytetään palon hidastimina, ovat: antimon -oksikloridi, SBOCL; antimon Pentoksidi, SBO5; Antimon -trikloridi, SBCL3; ja antimonitrioksidi, SBO3.
Elektroniikkakenttä
Sitä käytetään puolijohteiden, diodien, keskimmäisen infrapunailmaisimien valmistuksessa ja transtorien kehittämisessä. Puolijohdeteknologiassa käytetty korkea puhtaus antimonia saadaan vähentämällä antimoniyhdisteitä vedyn kanssa.
Voi palvella sinua: liukoisuuteen vaikuttavat tekijätLääketieteen ja eläinlääketieteen
Antimon -yhdisteitä on käytetty lääketieteessä muinaisista ajoista lähtien, kuten eméticas ja antiprotozoa. Kaliumkalium -tartratoa (esteettinen tartari) käytettiin antiskaluina pitkään; Käytetään myös odotustena, kalvoa ja eméticoa.
Antimonisuoloja on käytetty myös märehtijöiden eläinten ihon ilmastoinnissa; kuten aniomaliini ja litium ja antimonit -tiomalaatti.
Meglumiini -antimoni on lääke, jota käytetään leishmaniaasin hoidossa kotieläinten ulkoisissa valokeissa. Vaikka terapeuttisia etuja oli vähän.
Pigmentit ja maalaukset
Antimoniyhdisteitä käytetään maalien ja kaatolaitteen kehittämisessä emaloissa. Niitä käytetään myös Bermellónissa, keltaisissa ja oransseissa pigmenteissä, jotka ovat antimonisulfidien hitaan hapettumisen tuotteita.
Joitakin sen orgaanisia suoloja (Tartratos) käytetään tekstiiliteollisuudessa auttamaan tiettyjen väriaineiden linkkejä.
Antimon -sulfidia käytettiin muinaisessa Egyptissä kosmeettisena silmien pimeässä.
Muut käyttötarkoitukset
Joitakin antimonisuoloja käytetään pinnoiteagentteina televisionäytöillä muodostettujen mikroskooppisten kuplien poistamiseksi. Antimoni -ionit ovat vuorovaikutuksessa hapen kanssa, poistaen niiden taipumuksen muodostaa kuplia.
Antimon -sulfidia (III) käytetään joidenkin tietoturvaottelujen päähän. Antimon -sulfidia käytetään myös autojarrutyynyissä käytettyjen materiaalien kitkakerroimen stabiloinnissa.
Isotooppi 124SB: tä yhdessä berylliumin kanssa käytetään neutronien lähteenä, energian keskimäärin 24 keV: n ollessa. Lisäksi antimonia käytetään katalysaattorina muovien tuotannossa.
Riskejä
Se on hauras elementti, joten ympäristön epäpuhtausjauhe voi tapahtua manipuloinnin aikana. Antimon -pölylle altistuneissa työntekijöissä on havaittu, että korkean hengitysteiden ja sidekalvontulehduksen tulehdukset ja sidekalvotulehdus.
Pneumkonioosia on kuvattu, joskus yhdistettynä obstruktiivisiin keuhkojen muutoksiin pitkittyneiden näyttelyiden jälkeen.
Antimonitrioksidi voi aiheuttaa vaurioita sydämen toiminnalle, joka voi olla kuolevainen.
Tälle elementille altistuneilla ihmisillä on havaittu pustulien iho -infektioiden läsnäolo, väliaikaisesti.
Tämän metallin jatkuva pieniannoksen saanti voi aiheuttaa ripulin oksentelua ja mahahaavoja. Myös maksimaalinen siedettävä pitoisuus ilmassa on 0,5 mg/m3.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Manny. (11. maaliskuuta 2009). Keltainen antimoni ja räjähtävä antimoni. Haettu: AntimonProperties.Blogin.com
- Prof. Ernst Cohen ja J. C. Van den Bosch. (1914). Antimonin allotropia. Menettelyt Royal Acad. Amsterdam. Osa. Xvii.
- Wikipedia. (2019). Antimoni. Haettu: vuonna.Wikipedia.org
- Advameg, Inc. (2019). Antimoni. Palautettu: Chemistry Explaed.com
- Mc'oneal Saber. (15. syyskuuta 2018). Kemia: SB-antimonin ominaisuudet ja soveltaminen. Palautettu: väliaine.com
- « Biogeografiahistoria, mitä tutkimuksia ja tutkimusesimerkkejä
- Äänen pilaantumisen syyt, seuraukset, ratkaisut »

