Asparagiiniominaisuudet, rakenne, toiminnot, biosynteesi
- 4587
- 667
- Shawn Stanton II
Se Parsa (ASN tai N) on tärkeä aminohappo solusignaloinnille ja proteiinien ja hiilihydraattien välinen liitto. Tämä on yksi 22 emäksisestä aminohapposta ja on luetteloitu ei -välttämättömäksi, koska nisäkkäiden runko syntetisoi sen.
Tämä aminohappo luokitellaan polaaristen aminohappojen ryhmään ilman kuormitusta ja se oli ensimmäinen paljain aminohappo, tosiasia, joka tapahtui vuonna 1806, missä ranskalaiset kemikaalit Vauquelin ja eräänlainen yrttirakenteinen kasvi) eristettiin parsamehusta (eräänlainen yrttivärinen kasvi) ja Ryöstö.
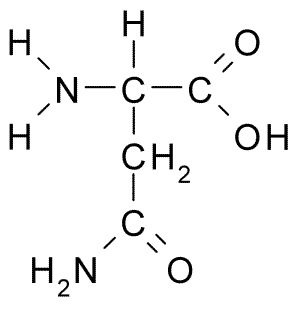
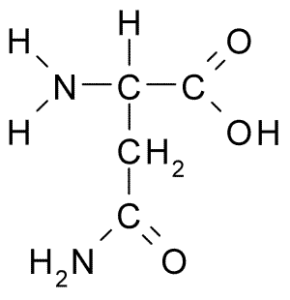 Aminohappoasparagiinin kemiallinen rakenne (lähde: Borb, Wikimedia Commonsin kautta)
Aminohappoasparagiinin kemiallinen rakenne (lähde: Borb, Wikimedia Commonsin kautta) Varhaisesta löytöstään huolimatta asparagiinin biologista ja ravitsemuksellista roolia ei tunnustettu, vaan yli 100 vuotta myöhemmin, kun vuonna 1932 sen läsnäolo hampunsiemenissä läsnä olevan proteiinin rakenteessa vahvistettiin.
Asparagiini ja glutamiini toimivat substraattina kahden erittäin yleisen aminohapon keskellä oleville ryhmille proteiineissa: asparatic (asparagiinihappo) ja glutamaatin (glutamiinihappo), vastaavasti. Asparagiini ja glutamiini hydrolysoidaan helposti näissä aminohapoissa entsymaattisella vaikutuksella tai hapolla ja emäksisillä yhdisteillä.
Monilla proteaasi -seriinientsyymeillä, jotka ovat vastuussa hydrolysoivista peptidisidoksista, on asparagiini heidän aktiivisen kohdan sivuketjussa. Tällä jäännöksellä on negatiivinen osittainen kuorma, ja se vastaa liittämisestä täydentävällä tavalla valkoisten peptidien positiivisen kuormituksen kanssa, lähestyen leikkauspaikkaa.
Asparagiinin oksalasetaattisynteesiä vastaavaa entsyymiä käytetään kemoterapeuttisissa käsittelyissä, ja sitä kutsutaan L-asparaginaasiksi, joka vastaa asparagiinin Amidan hydrolyyttisen pirstoutumisen katalysoinnista aspartaattiin ja ammoniumiksi.
Asparaginaasi on yli ekspressoitu ja puhdistettu Escherichia coli, Injektoidaan lasten potilaille, joilla on akuutti lymfoblastinen leukemia, koska sekä normaalit että pahanlaatuiset lymfosyytit riippuvat asparagiinin sieppauksesta veressä kasvua ja kertolaskua varten.
[TOC]
Ominaisuudet ja rakenne
Kaikissa aminohappojen kemiallisissa rakenteissa on karboksyyliryhmä (-COH), aminohiryhmä (-NH3+), vety (-H) ja R- tai substituenttiryhmä, joita yhdistää sama keskus hiiliatomi, joka tunnetaan nimellä hiili α.
Aminohapot eroavat toisistaan sivuketjujensa identiteetin perusteella, jotka tunnetaan R -ryhminä ja jotka voivat vaihdella koon, rakenteen, funktionaalisten ryhmien ja jopa sähkövarauksen suhteen.
R -ryhmien hiiliatomit tunnistavat kreikkalaisen aakkosten kirjaimet. Siten asparagiinin tapauksessa R -ketjun hiilet tunnistetaan β- ja y -hiilinä.
Voi palvella sinua: Agar XLD: Perusta, valmistelu ja käyttötarkoituksetToisen nimikkeiden tyypin mukaan karboksyyliryhmän (-COH) hiiliatomi on lueteltu C-1: ksi, joten numeroinnin jatkuessa hiili-α olisi C-2 ja niin edelleen.
Asparagiinimolekyylissä on neljä hiiliatomia, mukaan lukien hiili-a, karboksyyliryhmän hiili ja kaksi hiiliatomia, jotka ovat osa R-ryhmää, joka tunnetaan nimellä karboksamidi (-CH2-Co-Co-NH2).
Tätä karboksamidiryhmää löytyy vain kahdesta aminohaposta: asparagiinista ja glutamiinista. Sillä on ominaisuus, että se voi muodostaa vety silloja erittäin helposti aminoherryhmän (-NH2) ja karbonyyliryhmän (-CO) kautta.
Luokittelu
Asparagiini kuuluu polaaristen aminohappojen ryhmään ilman kuormaa, jotka ovat hyvin liukoisia aminohappoja vedessä ja erittäin hydrofiiliset (johtuen niiden monien vety sillojen muodostumiskapasiteetista).
Polaaristen aminohappojen ryhmässä ilman kuormaa ovat myös seriini, treoniini, kysteiini ja glutamiini. Kaikki nämä ovat yhdisteitä "Viiveinen”Koska heillä on Polar -ryhmä sen R -ketjussa, joka myötävaikuttaa kuormitusten neutralointiin.
Kaikki polaariset aminohapot ilman kuormaa eivät ole ionisoituvia pH: ssa lähellä 7 (neutraali), eli niillä ei ole positiivisia tai negatiivisia varauksia. Happamissa ja emäksisissä väliaineissa substituentit ovat kuitenkin ionisoituja ja hankivat taakan.
Stereokemia
Aminohappojen keskushiili tai a.
Stereoisomeerit ovat spekulaarisia kuvia molekyylistä, joilla on sama molekyyl kaava, mutta joita ei voida toistensa kanssa, kuten kädet (vasen ja oikea). Ne on merkitty kirjaimella D tai L, koska kokeellisesti näiden aminohappojen liuokset pyörivät polarisoitua valotasoa vastakkaisiin suuntiin.
Aminohappojen yleinen epäsymmetria tekee näiden yhdisteiden stereokemian, joka on erittäin tärkeä, koska jokaisella on erilaisia ominaisuuksia, syntetisoidaan ja osallistuu erilaisiin aineenvaihduntareitteihin.
Asparagiinia löytyy D-asparagiini- tai L-asparagiinimuodosta, jälkimmäinen on luonteeltaan yleisimpiä. Se syntetisoidaan L-synteesaasilla ja metaboloitu L-asparaginaasille, molemmat entsyymit ovat erittäin runsaasti selkärankaisten maksassa.
Funktiot
Asparagiinin vety siltojen muodostamisen helppous tekee siitä tärkeän aminohappon proteiinien rakenteelliselle stabiilisuudelle, koska se voi muodostaa sisäisiä vety silloja muiden aminohappojen sivuketjuilla, jotka tekevät niistä.
Voi palvella sinua: 25 esimerkkiä aseksuaalisesta lisääntymisestäAsparagiinia löytyy yleensä tyypillisten vesipitoisten väliaineiden pinnalta, stabiloimalla niiden rakenne.
Monet glykoproteiinit voivat sitoutua hiilihydraatteihin tai hiilihydraatteihin asparagiinin, treoninen tai seriinitähteen läpi. Asparagiinin tapauksessa asetyyli galaktosamiini liitetään yleensä amino-ryhmään N-glykosylaatiolla.
On tärkeää korostaa, että kaikissa N-glykosyloiduissa glykoproteiineissa hiilihydraatit sitoutuvat näihin asparagiinitähteen kautta, joka on tietyllä alueella, joka on merkitty ASN-X-SER/THR: llä, missä x on minkäänlaista aminohappoa.
Nämä glykoproteiinit on koottu endoplasmisessa retikulumissa, missä ne glykosyloidaan, kun ne käännetään.
Biosynteesi
Kaikki eukaryoottiset organismit rinnastavat ammoniakin ja muuttavat sen glutamaatiksi, glutamiiniksi, karbamilifosfaatiksi ja asparagiiniksi. Asparagiini voidaan syntetisoida glykolyyttisistä välittäjistä, sitruunahapposyklissä (oksalasetaatista) tai ruokavaliossa käytetyistä esiasteista.
Syntetaasi -asparagiini -entsyymi on glutamiinista ja ATP: stä riippuvainen amidotransferaasi, jonka ATP ja epäorgaaninen pyrofosfaatti (PPI) sylkee ja käyttää ammoniakkia tai glutamiinia katalysoimaan amidointireaktiota ja muuttamaan aspartaatin asparagiiniksi ja muuntamaan aspartaatti asparagiiniksi ja perparatiini.
Sekä bakteereilla että eläimillä on kuitenkin syntetaasi -asparagiini, entsyymi bakteereissa käytetään kuitenkin ammoniumioni typen luovuttajana, kun taas nisäkkäissä synteettisen syntetiikan synteesasi käyttää glutamiinia typpiryhmän pääluovuttajana.
ATP: n entsymaattinen repeämä AMP: lle ja epäorgaaniselle pyrofosfaatille (PPI) yhdessä glutamiinin kanssa Amida-ryhmän luovuttajana ovat tärkeimmät erot suhteessa L-glutamiinin biosynteesiin eri organismien välillä.
Heikkeneminen
Suurin osa asparagiinimetaboliaa koskevista tutkimuksista on tehty kasveissa, kun otetaan huomioon tosiasia, että alun perin nisäkkäiden tutkimuksia haittasivat menetelmien puute, joka on riittävän herkkä aminohappotesteille monimutkaisempien järjestelmien tasolla.
L-asparagiinia hydrolysoituu jatkuvasti nisäkkäillä L-asparaginaasilla aiheuttaen asparagiinihappoa ja ammoniumia. Sitä käytetään glykoproteiinien synteesiin ja se on yksi sitruunahapposyklin oksalasetaatin tärkeimmistä edeltäjistä.
Asparaginaasientsyymi katalysoi asparagiinihydrolyysiä aspartaattiin, myöhemmin aspartaatti transaminoidaan α-dateglutaraatilla glutamaatin ja oksalasetaatin tuottamiseksi.
Voi palvella sinua: EpiblastSynteta-asparagiini, joka tunnetaan myös nimellä aspartaatti-amoniaco-ligaasi, löytyy runsaasti nisäkkäiden aivosoluista.
Kun tämän entsyymin matalat tasot havaitaan kehossa, muodostuu "aminokasidopatiot", koska esiastesubstraatit kerääntyvät aivosolujen sytoplasmaan.
Ruoat, joissa on runsaasti asparagiinia
Ihmisillä, joilla on akuutti lymfoblastista leukemiaa.
Useiden ruokien joukossa, joilla on korkea asparagiinipitoisuus.
On olemassa L-asparagiinikonsentraatteja, jotka on muotoiltu korkean kilpailun urheilijoille, koska niiden kulutus auttaa uudistamaan kudokset muodostavat proteiinit.
Lisäksi ihmiset, joilla on aminohapposynteesissä alijäämä.
Asparagiinia on helpompi metaboloida sen L-asparagiinimuodon kautta, koska monet niiden aineenvaihduntaan osallistuvista entsyymeistä eivät tunnista D-asparagiinimuotoa, ja siksi kaikki ruoan ruokaan nautitut parsagiinit eivät ole käytettävissä erilaisiin organism-prosesseihin.
Runsas asparagiinin saanti voi olla hyödyllistä, mutta ei suositella.
Viitteet
- Cooney, D. -Lla., Capizzi, r. Lens., & Handschumacher, R. JA. (1970). Animien ja ihmisen L-asparagiinimetabolian arviointi. Syöpätutkimus, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J -., & Jopa, h. Lens. (1976). D-asparagiinin käyttö Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, S., Ajewole, e., & Marsolais, F. (2017). Edistykset asparagiinin aineenvaihdunnassa. Sisään Edistyminen kasvitieteessä Osa. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, S. (1985). Asparagiiniin sidottujen oligosakkaridien kokoonpano. Biokemian vuosikatsaus, 54 (1), 631-664
- Mathews, c. K -k -., & Ahern, k. G. (2002). Biokemia. Pearson -koulutus.
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Yamada, k., Hashizume, D., Shimizu, t., & Yokoyama, S. (2007). L-asparagiini. Kristallografinen teko Osa E: rakenneraportit verkossa, 63 (9), 3802-3803.

