Bentsaldehydi
- 2270
- 58
- Joshua Emmerich
Selitämme, mitkä bentsaldehydi, sen fysikaaliset ja kemialliset ominaisuudet, kemiallinen rakenne, sovellukset ja synteesi ovat
 Bentsaldehydin kemiallinen rakenne
Bentsaldehydin kemiallinen rakenne Mikä on bentsaldehydi?
Hän Bentsaldehydi Se on orgaaninen yhdiste, jonka kemiallinen kaava on c6H5Köyhä. Huoneen lämpötilassa se on väritön neste, joka voi tulla kellertävän säilytystilassa. Edustaa yksinkertaisin aromaattinen aldehydi ja eniten käytetty teollisesti. Tässä Formil -ryhmä on kytketty suoraan bentseenirenkaaseen.
Sitä löytyy luonnollisesti kasvien varren, lehtien ja siementen aivokuoresta, kuten: manteli, kirsikka, persikka ja omena. Sitä löytyy myös öljyöljyistä, Patchulísta, Jacinnosta ja Canangasta. Bentsaldehydi voi absorboida iho ja keuhkot, mutta metaboloituu nopeasti bentsoehapoksi.
Tämä yhdistetään glukuronihapon tai glysiinin kanssa, ja se erittyy virtsaan. Sitä käytetään joidenkin elintarvikkeiden aromina, hajuvesiteollisuudessa ja lääketeollisuudessa. Sen tärkeys on, että bentsaldehydistä yhdisteet, kuten bentsyylihappo, cynamiinihappo, mandeliahappo jne.
Aikaisemmin nimitetyillä yhdisteillä on lukuisia käyttötarkoituksia. Myös bentsaldehydi on yhteensopimattomia polttoainetta, jolla on voimakkaat hapettavat aineet, vahvat hapot ja pelkistävät aineet ja valot.
Bentsaldehydi fysikaaliset ja kemialliset ominaisuudet
Kemialliset nimet
Bentsaldehydi, bentsoic, bentsenokarboniaalinen, fenyylimetanaalinen ja bentsenokarboksalaldehydi aldehydi.
Molekyylikaava
C7H6O o c6H5Köyhä
Väri
Se on väritön neste, josta voi tulla kellertävä.
Haju
Samanlainen kuin katkera manteli.
Maku
Polttava aromaattinen.
Kiehumispiste
- 354 ºF nopeudella 760 mmHg.
- 178,7 ºC.
Fuusiopiste
- 15 ºF.
- 26 ºC.
Liukoisuus
- Vedessä, 6 950 mg/l 25 ° C: ssa, koska se on pääosin apolaarinen yhdiste ja on vuorovaikutuksessa heikosti vesimolekyylien kanssa.
- Sekoittuu alkoholin, eetterin, kiinteiden ja haihtuvien öljyjen kanssa.
- Liukoinen nestemäiseen ammoniumiin, apolaariseen liuottimeen.
Tiheys
- 1 046 g/cm3 68 ºF.
- 1 050 g/cm3 15 ºC.
- Sen höyry on tiheämpi kuin ilma: 3,65 kertaa suhteessa tähän.
Vakaus
Se on vakaa huoneenlämpötilassa. Kuitenkin hapettuna ilmassa bentsoehapoksi.
Goo
1 321 cp 25 ° C: ssa
Rakenne
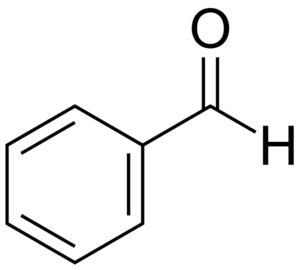
Kuten ensimmäisessä kuvassa voidaan nähdä, bentsaldehydin rakenne. Joten bentsaldehydi on orgaaninen, aromaattinen ja polaarinen yhdiste.
Mikä on sen molekyyligeometria? Koska kaikissa bentseenirenkaan muodostavissa hiiliatomeissa on SP2 -hybridisaatio, samoin kuin formyyliryhmän, molekyyli lepää samalla tasolla, ja näin ollen se voidaan visualisoida neliönä (tai suorakulmio, nähty aksiaalisesti).
Molekyylien väliset vuorovaikutukset
Formil -ryhmä muodostaa pysyvän dipolimomentin bentsaldehydimolekyylissä, vaikkakin huomattavan heikko verrattuna bentsoehappohapeen.
Tämän avulla voit olla voimakkaampia molekyylien välisiä vuorovaikutuksia kuin bentseenillä, joiden molekyylit voivat olla vuorovaikutuksessa vain Lontoon voimien kautta (indusoidut dipoli-dipol-dipmerit).
Yllä oleva heijastuu sen fysikaalisissa ominaisuuksissa, kuten kiehumispiste, joka on kaksi kertaa parempi kuin bentseenin (80 ºC).
Lisäksi Formil -ryhmästä puuttuu kyky muodostaa vety silloja (vety liittyy hiileen, ei happea). Tämän ansio.
Käyttää/sovelluksia
Lisäaine- ja aromatisoiva ja aromiaine
Se on yhdiste, joka toimii perustana lääkkeille, väriaineille, hajusteille ja hartsiteollisuudelle. Sitä voidaan käyttää myös liuottimena, pehmittimenä ja voiteluaineena alhaisissa lämpötiloissa. Sitä käytetään ruoan ja tupakan aromatisointiin tai maustamiseen.
Se voi palvella sinua: kaliumdikromaatti: kaava, ominaisuudet, riskit ja käytötSitä käytetään makujen valmistuksessa, kuten manteli, kirsikka ja mutteri. Sitä käytetään myös aromatisoivana aineena purkitetussa kirsikkasiirappissa. Se puuttuu violetin, jasmiinin, akaasian, auringonkukan jne. Alueiden laatimiseen., ja sitä käytetään saippuanvalmistuksessa. Sitä käytetään polttoaineena ja polttoaineen lisäaineena.
Epätavalliset sovellukset
Se puuttuu reagenssina otsonin, fenolin, alkaloidien ja metyleenin määrittämisessä. Se toimii kasvien kasvun säätelyn välittäjänä.
Bentsaldehydi ja n-heptaldehydi estävät lumen uudelleenkiteyttämistä, välttäen syvien jääkerroksien muodostumista aiheuttaen lumi-almuja. Tämä käyttö on kuitenkin vastustettu, koska se on ympäristön pilaantumisen lähde.
Hylkivä
Bentsaldehydiä käytetään mehiläisten hylkivänä, käyttämällä pesää yhdessä savun kanssa pesän mehiläisten siirtämiseksi ja kyvyttömyys työskennellä ilman näissä riskiä, välttäen puremia.
Malakiitin synteesissä
Malakiittivihreä on yhdiste, joka on syntetisoitu bentsaldehydin interventiolla. Väriainetta käytetään kalanviljelyssä kalatautien torjumiseksi, kuten valkoisten pisteiden tuttavuus ja sieni -infektiot.
Sitä voidaan käyttää vain akvaarioissa, koska haitallisia vaikutuksia nisäkkäisiin on ilmoitettu, joista karsinogeneesi, mutageneesi, teratogeneesi ja kromosomaalinen laskutus; Siksi sen käyttö on kielletty monissa maissa.
Sitä käytetään myös mikrobiologiassa bakteerien itiöiden värjäytymiseen.
Synteettinen välittäjä
- Bentsaldehydi on välittäjä mausteissa käytetyn kainanhappojen synteesissä, mutta sen pääkäyttö on hajuvesiteollisuudessa käytettyjen metyyli-, etyyli- ja bentsyyliesterien hankkiminen. Cinamiinihappo indusoi sytastaasia ja ihmisen ihmisen kasvainsolujen pahanlaatuisten ominaisuuksien kääntämistä In vitro.
- Bentsyylialkoholin synteesiin puuttuvat bentsaldehydi, jota käytetään elintarvikkeiden mausteena ja teollisuusliuottimena, sen päätehtävänä on toimia välittäjänä farmaseuttisessa teollisuudessa käytettyjen yhdisteiden synteesissä ja hajusteiden, mausteiden ja jonkin verran aniliinin tuotannossa väriaine.
- Bentsaldehydi on välittäjä mandellihapon synteesissä. Tätä käytetään iho -ongelmien, kuten ikääntymisen hoidossa auringonvalolle, epäsäännölliselle pigmentaatiolle ja aknelle.
- Sillä on antibakteerinen käyttö, joka toimii oraalisena antibioottina virtsatieinfektioissa.
Synteesi
Bentsaldehydin synteesin eniten käytetty muoto on tolueenin katalyyttisellä hapettumisella, käyttämällä mangaanioksidikatalyyttejä (MNO2) ja kobolttioksidi (COO). Molemmat reaktiot suoritetaan rikkihapolla keinona.

