Litiumbromidirakenne, ominaisuudet, käytöt, riskit
- 1238
- 173
- Louis Moen
Hän Litiumbromidi Se on emäksisen metallin neutraali suola, jonka kemiallinen kaava on libr. Kaava ilmaisee, että sen kiteinen kiinteä aine koostuu Li -ioneista+ ja br- Suhteessa 1: 1. Kiteesi ovat valkoisia tai kevyitä beigejä. Se on hyvin liukoinen veteen ja se on myös melko hygroskooppinen suola.
Tämä viimeinen ominaisuus sallii sen käytön kuivausaineena ilmastointi- ja jäähdytysjärjestelmissä. Samoin litiumbromidia käytettiin 1900 -luvun alusta lähtien tiettyjen mielenterveyshäiriöiden hoidossa, mikä hylkäsi sen käytöstä suolan sopimattoman käytön vuoksi.
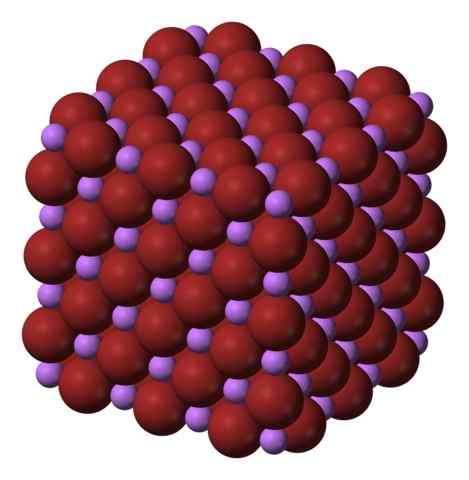
 Libr: n kuutiomettinen kiteinen rakenne. Lähde: Benjah-BMM27 Wikipedian kautta.
Libr: n kuutiomettinen kiteinen rakenne. Lähde: Benjah-BMM27 Wikipedian kautta. Libr tuotetaan käsittelemällä litiumkarbonaatti, Li2Yhteistyö3, bromhytihapella. Keskipitkän lämmittämisen jälkeen saostuu vesiliuoksessa hydraattina.
Tämä suola ärsyttää ihoa ja silmiä kosketuksella, mikä aiheuttaa hengityskanavien ärsytystä hengittämällä. Litiumsuolojen saanti voi aiheuttaa pahoinvointia, oksentelua, ripulia ja huimausta.
[TOC]
Litiumbromidirakenne
Libr -kaava tekee selväksi, että LI/BR: n osuus on yhtä kuin 1; Jokaiselle kationille Li+ BR -anionia on oltava- vastoin. Siksi tämä osuus on pidettävä vakiona libr -kideen jokaisessa nurkassa.
Ionit li+ ja br- Ne houkuttelevat toisiaan vähentämällä tasavertaisten kuormitusten välisiä torjumia kuutiometrien jalokivin aiheuttamiseksi; Tämä on isomorfista NaCl: lle (ylivoimainen kuva). Huomaa, että koko sarjassa on kuutio geometria.
Tässä kristallissa Li+ Ne ovat pienempiä ja niissä on kevyt violetti väri; kun taas br- Ne ovat tilaa vieviä ja voimakkaampia ruskeita väriä. Havaitaan, että jokaisessa ionissa on kuusi naapuria, mikä on sama kuin sanomalla, että heillä on oktaedrinen koordinointi: libr6 tai li6Br; Kuitenkin, jos yhtenäistä solua otetaan huomioon, LI/BR: n osuus pysyy 1.
Voi palvella sinua: Kristillinen rakenneTämä on kiteinen kiteinen rakenne, jonka libr on mieluiten. Se voi kuitenkin muodostaa myös muun tyyppisiä kiteitä: Wurzita, jos kiteytyy alhaisissa lämpötiloissa (-50 ° C) substraatilla; o Kuutio, joka on keskittynyt runkoon tai CSCL -tyyppiin, jos kuutiosuola altistetaan korkean paineessa.
Ja lasi
Yllä olevaa voidaan soveltaa libr -vedettömään. Tämä suola on hygroskooppinen, ja siksi se voi absorboida ympäristön kosteutta, vesimolekyylien välissä omiin kiteisiin. Siten libr · nh -hydraatit syntyvät2Tai (n = 1, 2, 3 ..., 10). Jokaiselle hydraatille kiteinen rakenne on erilainen.
Esimerkiksi kristallografiset tutkimukset määrittelivät, että libr · h2Tai omaksua perovskita -tyyppirakenne.
Kun nämä hydraatit ovat vesipitoisessa liuoksessa, ne voivat ylivuotaa ja litraloida itseään; Eli he omaksuvat kiteisen, mutta molekyylisesti epäjärjestysrakenteen. Tällaisissa olosuhteissa vesisiltojen tulee melko tärkeitä.
Ominaisuudet
Molekyylipaino
88 845 g/mol.
Ulkomuoto
Valkoinen kiteinen kiinteä tai kevyt beige.
Haju
Käymälö.
Sulamispiste
552 ºC (1.026 ºF, 825 K).
Kiehumispiste
1.256 ºC (2.309 ºF, 1.538 K).
Vesiliukoisuus
166,7 g/100 ml 20 ° C: ssa. Huomaa korkea liukoisuus.
Liukoisuus orgaanisiin liuottimiin
Liukoinen metanoliin, etanoliin, eetteriin ja asetoniin. Liukenee hieman pyridiiniin, aromaattiseen yhdisteeseen ja vähemmän napaisiin kuin edelliset.
Taiteindeksi (ηD)
1 784.
Kalorikapasiteetti
51,88 J/mol · K.
Tavallinen molaarinen entropia (Sθ 298)
66,9 j/mol · k.
sytytyspiste
1.265 ºC. Pidetään ei -palkkana.
Vakaus
Vakaa. Anhydra -muoto on kuitenkin erittäin hygroskooppinen.
Hajoaminen
Kun se hajoaa lämpenemällä, se aiheuttaa litiumoksidia.
Voi palvella sinua: klorogeenihappoPHE
Välillä 6 - 7 vesiliuoksessa (100 g/l, 20 ºC).
Reaktiivisuus
Litiumbromidi ei ole reaktiivinen normaaleissa ympäristöolosuhteissa. Voit kuitenkin kokea voimakkaita reaktioita vahvojen happojen kanssa, kun lämpötila nousee.
Veteen liukeneessa lämpötilaa nousee, mikä johtuu nesteytyksen negatiivisesta entalpiasta.
Tuotanto
Libr tapahtuu reagoimalla litiumhydroksidia tai litiumkarbonaattia bromhytihapon kanssa neutralointireaktiossa:
Li2Yhteistyö3 + Hbr => libr +co2 + H2JOMPIKUMPI
Litiumbromidi saadaan hydraattina. Vedetön muodon saamiseksi on välttämätöntä lämmittää hydratoitu suola tyhjiön alla.
Nimikkeistö
Nimi 'litiumbromidi' johtuu metallisesta halogenidista, joka on nimetty osakekannan mukaan. Muut nimet, jotka ovat yhtä päteviä, mutta vähemmän käytettyjä, ovat litium -monobromure, systemaattisen nimikkeistön mukaan; ja litic -bromidi (+1: n ainutlaatuinen valenssi litiumille), perinteisen nimikkeistön mukaan.
Sovellukset
Kuivua
Libli. Tätä suolavettä käytetään kuivausaineena ilmastointi- ja jäähdytysjärjestelmissä.
Kuidut
Sitä käytetään lisäämään villan, hiusten ja muiden orgaanisten kuitujen määrää.
Farmaseuttiset adduktit
Libr muodostaa addukteja, joissa on joitain farmaseuttisia yhdisteitä, moduloimalla sen vaikutusta. Addukti on yhdistelmä koordinoimalla kahta tai useampaa molekyyliä ilman minkään yhtenäisen molekyylin rakenteellista muutosta.
Rauhoittava lääke
Litiumbromidia käytettiin alussa sedatiivisena tietyissä mielenterveyshäiriöissä, lopeta käyttö vuonna 1940. Tällä hetkellä käytetään litiumkarbonaattia; Mutta joka tapauksessa litium on elementti, joka aiheuttaa terapeuttista vaikutusta molemmissa yhdisteissä.
Se voi palvella sinua: Plumbose -oksidi (PBO): kaava, ominaisuudet, riskit ja käyttötarkoituksetBipolaarisen häiriön hoidossa käytetään litiumia, ja se on ollut hyödyllinen häiriön maanisten jaksojen hallinnassa. Litiumin uskotaan estävän herättävien välittäjäaineiden, kuten dopamiinin ja glutamiinihapon, aktiivisuutta.
Toisaalta neurotransmitterin gamma-amino-butrippihapon (GABA) välittämän estävän järjestelmän aktiivisuus kasvaa (GABA). Nämä toimet voivat olla osa litiumin terapeuttisen vaikutuksen perustaa.
Riskejä
Kosketusmyrkyllisyys
Ihon ärsytys ja herkistyminen, allergiat. Vakavat silmävammat tai silmien ärsytys hengitysteissä, sieraimissa ja kurkussa.
Nieleminen
Tärkeimmät litiumbromidin saannista johtuvat oireet ovat: maha -suolikanavan häiriöt, oksentelu ja pahoinvointi. Muita haitallisia vaikutuksia suolan nauttimiseen ovat levottomuus, kouristukset ja tietoisuuden menetys.
"Bromismina" tunnetussa tilassa voi esiintyä litiumbromidiannoksella, joka on yli 225 mg/päivä.
Bromismissa voi tapahtua joitain seuraavista oireista ja merkkejä: aknen paheneminen ja ruokahalun menetys, vapina, puheongelmat, apatia, heikkous ja maniakkinen levottomuus.
Viitteet
- Kemiallinen formulaatio. (2019). Litiumbromidi. Palautettu: quimica -formulaatio.com
- David C. Johnson. (10. heinäkuuta 2008). Uusi tilaus litiumbromidille. Luonto. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (S.F.-A. Rakenteellisen vaiheen siirtyminen litiumbromidissa: paineen ja lämpötilan vaikutus. [PDF]. Palautettu: NCPCM.sisään
- Takamuku et ai. (1997). Röntgenkuvaustutkimukset superjäähdytetyistä vesipitoisista litiumbromidi- ja litiumjodidiliuoksista. Kemian laitos, tieteen tiedekunta, Fukuoka University, Nanakuma, Jonan-KU, Fukuoka 814-80, Japani.
- Kansallinen bioteknologiatietojen keskus. (2019). Litiumbromidi. Pubchem -tietokanta, CID = 82050. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Litiumbromidi. Haettu: vuonna.Wikipedia.org
- Kuninkaallinen kemian yhdistys. (2019). Litiumbromidi. Chemspider. Toipunut: Chemspider.com
- « Alkyylihalogenuros -ominaisuudet, saava, esimerkkejä
- Meksiko 1800 -luvulla ja sosioekonomiset muutokset »

