Alkyylihalogenuros -ominaisuudet, saava, esimerkkejä
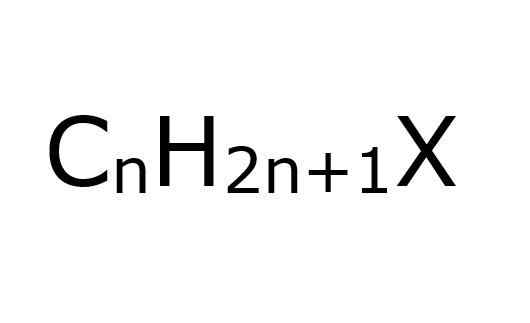
- 4471
- 267
- Dr. Travis Reichert
Se alkyylihalogenurot Ne ovat orgaanisia yhdisteitä, joissa hiiliatomi SP -hybridisaatiolla3 Halogeeni on kytketty kovalenttisesti (f, cl, br, i). Toisesta näkökulmasta on kätevää yksinkertaistaa olettaa, että he ovat haloalcanoja; Nämä ovat niille, jotka on korvattu joitain H -halogeeniatomeja.
Kuten nimestä voi päätellä, halogeeniatomit on liitettävä alquilical -ryhmiin R, jotta niitä voidaan pitää tämän tyyppisissä halogeenideissä; Vaikka rakenteellisesti ne voidaan korvata tai haarautua ja niissä on aromaattiset renkaat, ja ne ovat edelleen alkyylihalogenidi.
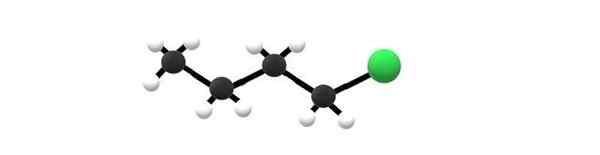 1-kloori-molekyyli, esimerkki alkyylihalogenidista. Lähde: Gabriel Bolívar.
1-kloori-molekyyli, esimerkki alkyylihalogenidista. Lähde: Gabriel Bolívar. Ylhäälläsi on 1-kloori-molekyyli, joka vastaa yhtä yksinkertaisimmista alkyylihalogenideista. Voidaan nähdä, että kaikilla heidän hiileillä on yksinkertaisia sidoksia ja niillä on myös SP -hybridisaatio3. Siksi vihreä pallo, joka vastaa CL: n atomia, on kytketty luurankoon, joka on johdettu butane -alkaanista.
Esimerkkejä, jotka ovat jopa 1-klooributanoja.
Sen Cho -molekyylistä4 Voit korvata H -atomit sanomalla, jodi. Jos H korvataan, CH on3I (yodometaani tai metyylijodidi). Kun kaksi H korvataan, CH on2Yllyttää2 (Diyodometaani tai metyleenimodidi). Seurasi ja lopuksi vaihdan kaikki h: n Chi3 (jodoformi) ja CI4 (Hiilitetrayoduro).
Vuokra -halogeenuroille on ominaista erittäin reaktiivinen, ja sillä on jaksollisen taulukon elektronegatiivisimmat atomit, on intuoitu, että mekanismien kautta sinfiinit vaikuttavat biologisiin matriiseihin.
[TOC]
Alkyylihalogenurien ominaisuudet
Tämän yhdisteiden perheen ominaisuudet riippuvat sen molekyylirakenteista. Kuitenkin verrattuna heidän alkaaniensa eroihin, jotka johtuvat yksinkertaisesta tosiasiasta C-X-linkeistä (x = halogeeniatomi).
Toisin sanoen C-X-linkit ovat vastuussa kaikista eroista tai samankaltaisuudesta yhden tai useamman alkyylihalogenurin välillä.
Aluksi C-H-linkit ovat melkein apolaarisia, kun otetaan huomioon alhainen elektronegatiivisuusero C: n ja H: n välillä; Sen sijaan C-X-linkillä on pysyvä dipolimomentti, koska halogeenit ovat enemmän elektronegatiivisia kuin hiili (erityisesti fluori).
Toisaalta jotkut halogeenit ovat kevyitä (F ja Cl), kun taas toiset ovat raskaita (Br ja I). Sen atomimassat myös muovaavat eroja C-X-linkkeissä; Ja puolestaan, suoraan halogeenidin ominaisuuksissa.
Siksi halogeenien lisääminen hiilivetyyn on yhtä suuri kuin sen napaisuuden ja molekyylimassan lisääminen; On sama tehdä siitä vähemmän haihtuvaa (jossain määrin), vähemmän syttyvää ja lisätä sen kiehumis- tai fuusiopisteitä.
Kiehumis- ja fuusiopisteet
Edellä esitetään lisääntyvässä järjestyksessä eri halogeenien koko ja siten paino:
F < Cl < Br < I
Sitten odotetaan, että F -atomeja sisältävät alkyylihalogenidit ovat kevyempiä kuin ne, joilla on br tai i atomeja.
Esimerkiksi joitain metaanista johdettuja halogeenuroja otetaan huomioon:
CH3F < CH3Cl < CH3Br < CH3Yllyttää
CH2F2 < CH2Cl2 < CH2Br2 < CH2Yllyttää2
Ja niin edelleen muiden johdannaisten tuotteille, joilla on korkeampi halogenointiaste. Huomaa, että järjestys ylläpidetään: fluori -halogeenurot ovat kevyempiä kuin jodi. Paitsi, että myös sen kiehumis- ja fuusiopisteet noudattavat tätä järjestystä; RF kiehuu matalissa lämpötiloissa kuin RI (r = Cho3, Tätä tapausta varten).
Voi palvella sinua: aromaattinen elektrofiilinen korvaus: mekanismi ja esimerkitSamoin kaikki nämä nesteet ovat värittömiä, koska niiden C-X-sidoksissa elektronit eivät voi absorboida tai vapauttaa fotoneja muiden energiatasojen matkustamiseksi. Kuitenkin, kun niistä tulee raskaampia, ne voivat kiteyttää ja osoittaa värejä (kuten jodoformi tekee, chi3-A.
Vastakkaisuus
C-X-linkit eroavat napaisuudesta, mutta yllä olevan käänteisessä järjestyksessä:
C-f> c-cl> c-br> c-i
Siksi C-F-linkit ovat napaisempia kuin C-I-linkit. Polaarisempana RF Halogenuros on yleensä vuorovaikutuksessa dipoli-dipolovoimien kautta. Samaan aikaan RBR- tai RI Halogenurosissa heidän dipolin hetket ovat heikompia ja Lontoon dispersiovoimien hallinnassa olevat vuorovaikutukset saavat suurempaa voimaa.
Liuotinvoima
Koska alkyylihalogenidit ovat polaarisempia kuin alkaanit, joista ne johtavat, ne lisäävät kykyään liuottaa suurempi määrä orgaanisia yhdisteitä. Tästä syystä he ovat yleensä parempia liuottimia; Vaikka se ei tarkoita, että he voivat korvata alkaanit kaikissa sovelluksissa.
On olemassa teknisiä, taloudellisia, ekologisia ja suorituskykykriteerejä, jotka mieluummin halogeenisoitua liuotinta verrattuna alkaaniin.
Nimikkeistö
Alkyylihalogenidin nimeämiseen on kaksi tapaa: yhteisen nimensä tai systemaattisen nimensä perusteella (IUPAC). Yleisiä nimiä on yleensä mukavampaa käyttää, kun RX on yksinkertainen:
CHCL3
Kloroformi: Yleinen nimi
Metyyli- tai trikloorimetaanitrikloridi: IUPAC -nimi.
Mutta systemaattiset nimet ovat parempia (ja ainoa vaihtoehto), kun ne ovat haarautuneet rakenteet. Ironista kyllä, yleiset nimet ovat jälleen hyödyllisiä, kun rakenteet ovat liian monimutkaisia (kuten viimeisimmässä osassa näkyvät).
IUPAC -järjestelmän mukaan yhdisteen nimeämissäännöt ovat samat kuin alkoholilla: pääketju tunnistetaan, mikä on pisin tai haaroitettu. Sitten hiilit luetellaan aloittaen lopusta lähinnä substituentteja tai seurauksia, nimeämällä aakkosjärjestys.
Esimerkki
Sen havainnollistamiseksi sinulla on seuraava esimerkki:
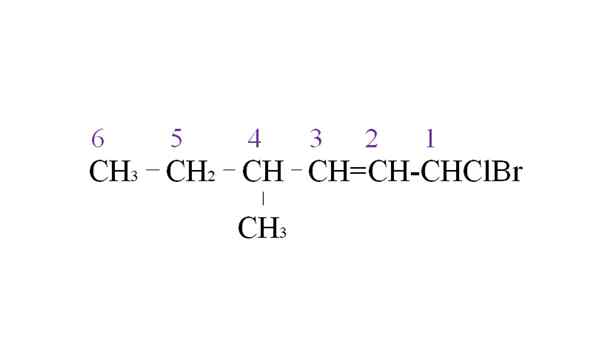 Vuokraa halogenidi esimerkkinä nimikkeistöstä. Lähde: Gabriel Bolívar.
Vuokraa halogenidi esimerkkinä nimikkeistöstä. Lähde: Gabriel Bolívar. Ensimmäinen haara on metyyliryhmä C-4: ssä; Mutta kaksinkertainen sidos tämä aikaisempi prioriteetti verrattuna sääntöyn nähden. Tästä syystä pisin ketju alkaa listata oikealta, ja sen johtama hiiliatomi, joka on kytketty kahteen halogeeniin: CL ja BR.
Luettelon avulla substituentit on nimetty aakkosjärjestyksessä:
1-bromi-1-clor-4-metyyli-2-heksen.
Saada
Alkyylihalogenidien saamiseksi molekyylit on toimitettava halogenointiprosessiin; toisin sanoen halogeeniatomien sisällyttäminen rakenteisiin, etenkin atomiin SP: n hiileen3.
Niiden saamiseksi tai syntetisoimiseksi on kaksi menetelmää: ultraviolettisäteily vapaan radikaalin mekanismin kautta tai lisäämällä nesteyksiä tai halogeeneja.
Halogenointi kevyellä tai ultraviolettisäteilyllä
Ensimmäinen, vähiten tarkoituksenmukainen ja pahimmassa saannossa, koostuu säteilytyksestä ultraviolettisäteilyllä (HV) Halogeenin läsnä ollessa. Esimerkiksi metaanin kloorauksen yhtälöt esitetään:
CH4 + Cl2 => Ch3Cl + HCl (ultraviolettivalossa)
CH3Cl + Cl2 => Ch2Cl2 + HCL
CH2Cl2 + Cl2 => Chcl3 + HCL
CHCL3 + Cl2 => CCL4 + HCL
Neljä yhdistettä (ch3Cl, ch2Cl2, CHCL3 ja ccl4) Ne muodostuvat, ja siksi on olemassa seos, joka voidaan altistua fraktionaaliseen tislaukseen. Tämä menetelmä ei kuitenkaan ole kovin käytännöllinen, ja se on edullista turvautua orgaaniseen synteesiin.
Voi palvella sinua: fenyyletikkahappo: rakenne, ominaisuudet, käytöt, vaikutuksetToinen esimerkki on n-heksaanin bromatio:
CH3CH2CH2CH2CH2CH3 + Br2 => Ch3(Br) chch2CH2CH2CH3 + HBR
Jälleen tässä reaktiossa käytetään valoa tai ultraviolettisäteilyä vapaiden radikaalien muodostumisen suosimiseksi. Bromi, kuten on voimakas punainen neste, väriltään reagoiessaan, tarkkaileen siten punaisesta värikkäästä värimuutoksesta, kun 2-bromohexania.
Nestekiden tai halogeenien lisääminen alkeeniksi
Toinen menetelmä alkyylihalogenurojen hankkimiseksi on alkoholien (ROH) tai alkeenien (R (R2C = cr2) Hydreace. Hydrakideilla on HX -yleinen kaava (HF, HCL, HBR ja HI). Esimerkki esitetään etanolilla jokaiselle heistä:
CH3CH2Oh + hf => ch3CH2F + h2JOMPIKUMPI
CH3CH2Oh + hcl => ch3CH2Cl + H2JOMPIKUMPI
CH3CH2Oh + hbr => ch3CH2Br + h2JOMPIKUMPI
CH3CH2Voi + hi => cho3CH2I + H2JOMPIKUMPI
Alkeenit voivat myös lisätä HX -molekyylejä kaksoissidoksiinsa muodostaen sekundaarisen alkyylihalogenuron.
CH2= Ch-ch3 + Hbr => brch2-CH2-CH3 + CH3-CHBR-CH3
Brch -tuote2-CH2-CH3 Se on 1-bromopropano ja cho3-CHBR-CH3 2-bromopropaani. Toinen on enemmistötuote, koska se on suurin vakaus, kun taas entinen tuotetaan vähemmässä määrin, koska se on epävakaampi. Tämä johtuu siitä, että Cho3Chbrch3 Se on toissijainen alkyylihalogenidi.
Hyvin samanlainen tapahtuu, kun alkeeniin lisätään X -molekyyli2-
CH2= Ch-ch3 + Br2 => Brch2-CHBR-CH3
Vierekkäisiin hiilihiiliin kytketyt alkyylihalogenidit, joissa on kaksi bromiatomia; naapuruston alkyylihalogenidi. Jos toisaalta samaan hiileen kytketyt kaksi bomia otettiin, siellä olisi geminal -alkyylihalogenidi, kuten seuraava:
Br2CH-Ch2-CH3
Reaktiot
Nukleofiilinen substituutio
Alkyylihalogenidien reaktiivisuudet ovat C-X-linkin hauraudessa tai resistenssissä. Mitä raskaampi halogeeni, sitä heikompi sidos on, ja siksi se rikkoutuu helpommin. Kemiallisissa reaktioyhteydet ovat rikki ja muodostetaan uusia; C-X-linkit ovat rikki C-G-linkin muodostamiseksi (g = uusi ryhmä).
Oikeamman kannalta X toimii lähtevänä ryhmänä ja G tulevan ryhmänä reaktiossa Nukleofiilinen substituutio. Miksi tämä reaktio tapahtuu? Koska X, koska se on enemmän elektronegatiivista kuin hiili, "varastaa" elektronisen tiheyden jättäen elektronien alijäämän, joka kääntyy positiiviseksi osittaiseksi kuormitukseksi:
CΔ+-XΔ-
Jos negatiivinen laji on lähellä (: g-) tai neutraali käytettävissä olevien elektronien kanssa (: g), joka pystyy muodostamaan vakaamman C-G-linkin, X lopulta korvataan G: llä. Yllä olevaa voidaan esittää seuraavalla kemiallisella yhtälöllä:
Rx +: g- => Rg + x-
Mitä heikompi C-X- tai R-X-linkki, sitä suurempi sen reaktiivisuus tai taipumus korvataan Nukleofiilinen aine (tai nukleofiili) g; eli ytimien ystävät tai positiiviset varaukset.
Esimerkit
Seuraavassa esitetään sarja yleisiä yhtälöitä nukleofiilisille substituutioille, jotka voivat kärsiä alkyylihalogenideista:
RX + OH- => Roh + x- (Alkoholit)
+ Tai'- => Ror' (Ethers, Williamsonin synteesi)
+ Yllyttää- => RI (alkyyli Yoduros)
+ CN- => Rcn (nitrilos)
+ Rypäle- => Rcoor '(esterit)
+ Nh3 => Rnh2 (Amiinit)
+ P (c6H5-A3 => Rp (c6H5-A3+ X- (Fosfoniumsuolat)
+ Sh- => Rsh (tioles)
Voi palvella sinua: kemian vaiheetNäistä esimerkeistä voidaan epäillä, että orgaanisen synteesin arvokkaita alkyylihalogenideja. Yksi monista puuttuvista substituutioista on Friedel Craftsin reaktio, jota käytetään "vuokraamaan" aromaattisia renkaita:
RX + ARH + ALCL3 => Rra
Tässä reaktiossa aromaattisen renkaan H korvataan ryhmällä R -rx.
Eliminointi
Vuokra -halogenidit voivat vapauttaa HX -molekyylejä eliminaatioreaktion kautta; Erityisesti dehydrohalogenointi:
R -2CH-CXR2 + vai niin- => R2C = cr2 + Hx
Sanotaan.
Grignardin reagenssisynteesi
Vuokra -halogenidit voivat reagoida tiettyjen metallien kanssa, jotka muodostavat Grignardin reagenssin, jota käytetään R -ryhmien lisäämiseen muihin molekyyleihin. Sen synteesin yleinen yhtälö on seuraava:
Rx + mg => rmgx
Esimerkit
Koko osioissa on jo mainittu useita esimerkkejä alkyylihalogenuroista. Jotkut muut, yksinkertaiset, ovat:
-Etyylikloridi, ch3CH2Cl
-Isopropiil fluoro (ch3-A2CH2F
-2-metyyli-3-klooripentano, ch3-Ch (ch3) -CHCL -CH2CH3
-Secbutilo yoduro, ch3CH2CH2I-CH-CH-3
-3-bromi-6-adheptano, ch3-CH2-CHBR-CH2-CH2-CH2Yllyttää
-3.4-DIBROMO-1-PENTENO, CH3-Chbr-chbr-ch = ch2
Sovellukset
Liuotin
Aikaisemmissa osioissa alkyylihalogenidien liuotinkapasiteetista. Tästä kiinteistöstä teollisuus on hyödyntänyt niitä puhdistusaineena joko tekstiiliaineiden, elektronisten komponenttien tai poistamispaikkojen suhteen.
Niitä käytetään myös maalausten liuottimina tai orgaanisia tai rasvanäytteitä lukemattomille analyyttisille testeille.
Orgaaninen synteesi
Vuokra -halogenurot ovat erittäin hyödyllisiä aromaattisten renkaiden "vuokraamiseen", samalla kun ne toimivat lähtölähteenä käytännöllisesti katsoen kaikkien muiden orgaanisten yhdisteiden perheiden synteesille. Synteettisesti RX: tä pidetään ryhmien tai R -ketjujen lähteenä, joita voidaan toivoa sisällyttämään erittäin aromaattiset yhdisteet.
Lääketeollisuus
Alussa mainittiin, että halogeeniatomit ovat vuorovaikutuksessa biologisten matriisien kanssa, joten organismeissamme ne eivät voi jäädä huomaamatta aiheuttamatta muutosta, positiivista tai negatiivista. Jos lääkkeellä on positiivinen vaikutus kehoon, halogeeniatomilla on tämä vaikutus voi kasvaa tai ei voi kasvaa.
Joten jos X on suoraan kytketty hiili SP -hybridisaatioon3, Tulee alkyylihalogenidi eikä halogenoitu johdannainen. Jotkut sellaisista halogenuroista on esitetty alla seuraavissa kuvasarjassa:
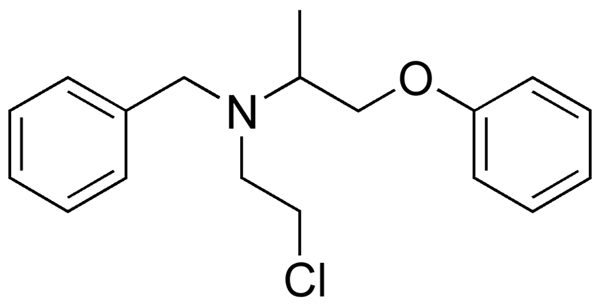 Fenoksibentsamiini, lääkitys, jota käytetään verenpaineen yhdistämiseen potilailla, joilla on feokromosytooma. Lähde: UTENNT: Mark Pea [julkinen verkkotunnus].
Fenoksibentsamiini, lääkitys, jota käytetään verenpaineen yhdistämiseen potilailla, joilla on feokromosytooma. Lähde: UTENNT: Mark Pea [julkinen verkkotunnus].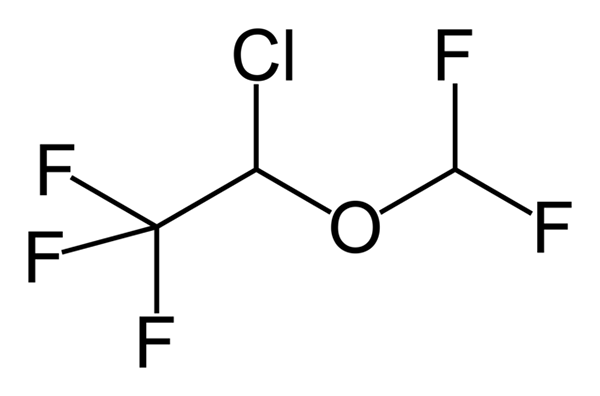 Isoflurano,. Lähde: Benjah-BMM27 [julkinen alue].
Isoflurano,. Lähde: Benjah-BMM27 [julkinen alue].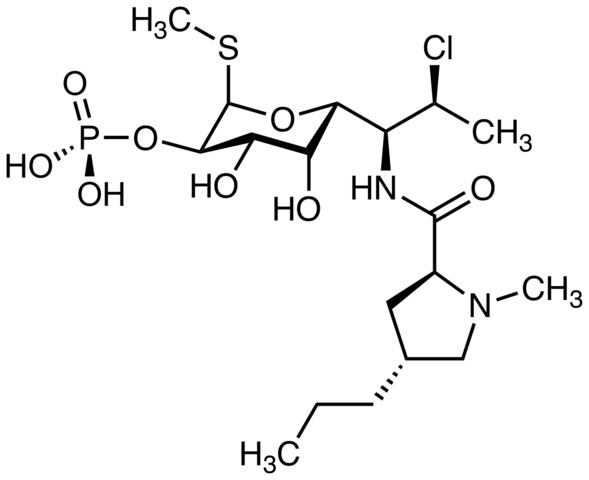 Klindamysiini, antibiootti. Lähde: M Mitcheltrate [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)].
Klindamysiini, antibiootti. Lähde: M Mitcheltrate [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Pimecrolimuusia, jota käytetään atooppisen ihottuman hoitoon. Voitko löytää klooriatomin? Lähde: Marinavladivok [CC0].
Pimecrolimuusia, jota käytetään atooppisen ihottuman hoitoon. Voitko löytää klooriatomin? Lähde: Marinavladivok [CC0]. Halomon, mahdollinen kasvaimenvastainen aine ja merilevälevien alkyylihalogenidi Hornemannii, luonnollinen lähde. Lähde: Jü [julkinen verkkotunnus]
Halomon, mahdollinen kasvaimenvastainen aine ja merilevälevien alkyylihalogenidi Hornemannii, luonnollinen lähde. Lähde: Jü [julkinen verkkotunnus]
Huomaa, että näissä viidessä lääkkeessä on ainakin yksi linkki CHO -tyypistä2-X tai CH-X; Eli halogeeni on kytketty SP -hiileen3.
Kylmäaineet
Kuuluisa Freón-12-kylmäaine (chcif2), Kuten muutkin fluoroalcanos tai hydrofluorihiilivedet, he korvasivat tässä toiminnossa ammoniakkia ja kloorofluorihiilivetyjä (CFC), koska jopa olematta haihduttamattomia tai myrkyllisiä aineita he tuhosivat otsonikerroksen; Vaikka Freón-12, koska se on reaktiivisempi, tuhoutuu ennen kuin saavuttaa tällaiset korkeudet.
Viitteet
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Clark Jim. (14. heinäkuuta 2016). Alkyylihalidien käyttö. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Gál, b., Bucher, c., & Burns, N. Z -z. (2016). Kiraaliset alkyylihalogidit: Alivatoiset kuviot lääketieteessä. Marine Drugs, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkyylihalogidesia. Haettu: Chemed.Kemia.Purduke.Edu
- Patkar prachi. (16. heinäkuuta 2017). Kaikki alkyylihalogenogeista: ominaisuudet, käytöt ja paljon muuta. Tiedekoru. Toipunut: Sciencestruck.com
- R -. alus. (2016). Alkyylihalogidesia. Toipunut: Hyperfysiikka.Phy-Astr.GSU.Edu
- Luku 9 - alkyylihalogenidit I. Toipunut: Cactus.Dixie.Edu
- Q -.-Lla. Eduardo Vega Barrios. (S.F.-A. Vuokraa halogeenuros: kiinteistöt, käytöt ja sovellukset. [PDF. Toipunut: cVonline.UAEH.Edu.MX
- « Typpihappo (HNO2) rakenne, ominaisuudet, synteesi
- Litiumbromidirakenne, ominaisuudet, käytöt, riskit »

