Palamislämpö

- 1656
- 78
- Edgar VonRueden
Mikä on palamislämpö?
Hän Palamislämpö Se on energia, joka vapautuu, kun tietty määrä materiaalia, yleensä yksi mol, reagoi eksotermisesti ilman hapen kanssa. Se on välttämätön termokemian ominaisuus polttoaineiden, alkoholien ja erityisesti hiilivetyjen, kuten butaanin ja metaanin, karakterisoinnissa.
Kun aine polttaa valoa ja lämpöä, energiaa, jota voidaan käyttää työskentelemään muilla ruumiilla. Esimerkiksi tuotettu lämpö pystyy lämmittämään suuria vesimääriä, joiden höyry painaa ympäristöä käyttäen joitain sähkögeneraattoreita; tai yksinkertaisesti, lämmittämällä höyrytettyjä ruokia.
 Keittiön kaasun palamisen aiheuttamaa lämpöä käytetään katojen ja ruoan lämmittämiseen
Keittiön kaasun palamisen aiheuttamaa lämpöä käytetään katojen ja ruoan lämmittämiseen Palamislämpö vaihtelee kaikkien aineiden välillä, vaikka sen kemiallinen luonne on pohjimmiltaan sama. Tämä variaatio vastaa suhteellista stabiilisuutta, toisin sanoen: mitä epävakaampi yhdiste, sitä suurempi vapautuva energia, edustettuna -Ah. Negatiivinen symboli tarkoittaa, että lämpö virtaa ulos.
Erilaisia -δH -arvoja käytetään vertaamaan suhteellista stabiilisuutta eri Alkauksen ja niiden isomeerien välillä. Se antaa sen myös olla vakaa.
Mittaus
Palamisen lämmittämiseksi tarvitaan kalorimetrinen pumppu. Sen sisällä aine reagoi hapen kanssa aktivoimalla sähköinen kipinä.
Sitten vapautuva lämpö lämmittää näytelokeroa ympäröivän veden määrän, joka mittaa lämpötilan ennen ja jälkeen palamisen, samoin kuin veden ja polttoaineen massan.
Joten vapautettu energia on yhtä suuri kuin:
CEH2O·mH2Tai · Δt
MissäEH2O Se on veden erityinen lämpö, 4.184 j/g · ºC, mH2Tai veden massa ja Δt sen lämpötilan muutos. Lopuksi, tämä jouleissa tai kaloriyksiköissä ilmaistu lämpö on jaettu kalorimetrisen pumpun sisälle asetetun polttoaineen massaan ja polttoaineen lämmön saamiseksi massa- tai moolia kohti.
Voi palvella sinua: mikä on lämmön mekaaninen vastine?Metallit eivät yhdistä itseään, vaan hapettuvat eri nopeuksilla lämpötilasta riippuen, jossa ne altistuvat. Heidän tuottamansa lämpö on halveksittava mitattavana samalla tavalla kuin se tehdään hiilivetyjen ja muiden polttoaineiden kanssa. Siksi ne eivät ole palavia aineita.
Potentiaaliset energiat
Palamisen aikana linkit rikkoutuvat uusien muodostamiseksi, vakaampi. Kaikkien molekyylilinkkien sisältämä energia on riippumaton sen liikkeestä, joten potentiaalista energiaa on.
Mitä suurempi potentiaalienergia, sitä epävakaampi molekyyli on, ja siksi se vapauttaa enemmän lämpöä, kun uudet linkit on perustettu.
Tietämään, mitkä nämä uudet linkit ovat, täydellisen palamisen tuotteet tulisi harkita: Co2 Hiilelle, h2Tai vetyä, eikä2 Typen kannalta. Hiilivetyjen suhteen niiden täydellinen palaminen tuottaa stökiometrisiä seoksia CO: sta2 ja h2JOMPIKUMPI.
Molemmat molekyylit, CO2 ja h2Tai niillä on erittäin alhaiset potentiaaliset energiat, koska niiden linkit (O = C = O ja H-O-H) ovat erittäin vakaita verrattuna hiilivetyyhteyksiin, joista ne tulivat (C-H ja C-C).
Suhteellinen vakaus
Potentiaaliset energiat ovat vapaasti. Mutta niiden variaatiot eivät ole, toisin sanoen näiden energioiden ero tuotteiden välillä (Co2 ja h2O) ja reagenssit (hiilivedyt).
Siksi nämä variaatiot tai mikä on sama, niiden palamisilmuu, voit tietää, mitkä ovat suhteellinen stabiilisuus hiilivetyjen tai isomeerien välillä.
Sulkeutuu
Alkaanit voivat olla lineaarisia, haarautuneita tai syklisiä. Lineaaristen alkanien tapauksessa sen palamislämpö vaihtelee sen ketjujen pituudesta riippuen; eli se riippuu kuinka monta yksikköä ch2 omistaa. Miettiä esimerkkiä n-heksaani, n-heptano ja n-oktaani:
Se voi palvella sinua: jodi: historia, ominaisuudet, rakenne, hankkiminen, riskit, käyttöCH3(CH2-A4CH3, -ΔH = 4163 kJ/mol
CH3(CH2-A5CH3, -ΔH = 4817 kJ/mol
CH3(CH2-A6CH3, -ΔH = 5471 kJ/mol
Voit nähdä, että sen palamisilmut vaihtelevat 654 kJ/mol. Tämä tarkoittaa, että jokainen cho2 joka lisätään ketjuun lisää palamislämpöä nopeudella 654 kJ/mol. Siten nonano, ch3(CH2-A7CH3, Sillä on palamislämpö, joka on yhtä suuri kuin 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Tämä on sama kuin sanoen, että pidemmillä ketjuilla on suurempia potentiaalisia energioita, ja siksi ne ovat epävakaampia.
Mahkaistut alkaanit ovat stabiilia kuin lineaariset, ja tämä johdetaan niiden palamisesta. Harkitse nyt oktaanin kolmea isomeeriä:
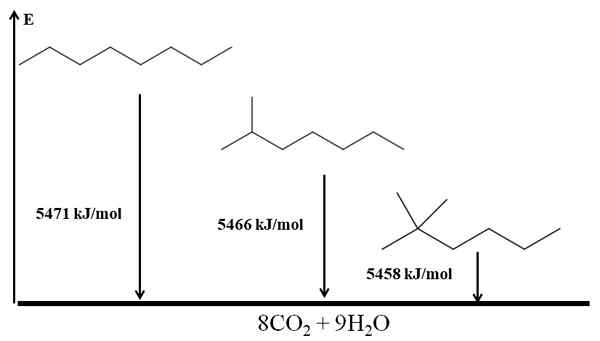 Palamislämpö kolme oktaanis -isomeeriä. Lähde: Gabriel Bolívar Molviewin kautta.
Palamislämpö kolme oktaanis -isomeeriä. Lähde: Gabriel Bolívar Molviewin kautta. Hän n-Octano on epävakaa, koska sen palamislämpö on suurin (5471 kJ/mol). Toisaalta isomeerit 2-metyylipeptano ja 2,2-dimetyyliheksaan. 2,2-dimetyyliheksaan on stabiilin siitä, että se on haaroittuneita kolmesta isomeeristä.
Alkeenia
Alkeenien suhteellinen stabiilisuus voidaan saada myös niiden palamisesta. Harkitse esimerkiksi neljää butenus -isomeeriä:
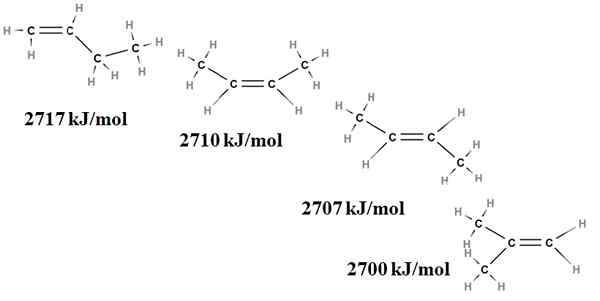 Poltto lämmittää buteno -isomeereille. Lähde: Gabriel Bolívar Molviewin kautta.
Poltto lämmittää buteno -isomeereille. Lähde: Gabriel Bolívar Molviewin kautta. Täällä emme enää puhu seurauksista, vaan kaksoissidoksen, C = C ja sen van der Waals -jännityksistä; eli elektroniset ja steeriset vääristykset kahden tilaa vievän ryhmän välillä, jotka sijaitsevat kaksoissidoksen samalla puolella.
Ensimmäinen isomeeri, 1-buteeni, on epävakaa, koska sen kaksoissidos on vähemmän korvattu (H2C = c). Tämä heijastuu sen palamislämpötilassa 2717 kJ/mol.
Voi palvella sinua: klorogeenihappoOikealla puolella CIS-2-buteeni on hiukan vakaampi, koska sen kaksoissidos korvataan paremmin. Mutta trans-2-buteeni on vielä enemmän, koska vaikka sillä olisi sama korvausaste, ryhmät Choons3 kaksoissidoksesta on trans -asemissa, toisin sanoen kaksoissidoksen eri puolilla. Huomaa, että trans-2-buteenin (2707 kJ/mol) lämpö on tuskin hiukan alempi kuin CIS-2-buteenin (2710 kJ/mol) lämpö.
Viimeinen isomeeri, 2-metyyli-2-buteeni, joka on myös korvattu myös CIS- ja Trans 2 Bungeo, on silti epävakaa kaikista. Tämä johtuu siitä, että molemmat ch3 Niitä löytyy yhdestä kaksoissidoksen hiilistä, joten ne ovat alkeenia CHO: n kanssa3 Kaksot.
Karbonyyliyhdisteet
Alkosten ja muiden hiilivetyjen lisäksi yleensä karbonyyliyhdisteiden (ketonit, aldehydit, karboksyylihapot) suhteellinen stabiilisuus liittyvät myös niiden palamislämpöihin.
Siten, mitä stabiloituneempi tai vähemmän reaktiiviset heidän ryhmänsä c = o, alaikäiset ovat heidän palamismuutoksensa.
Esimerkiksi butanalin palamislämpö, ch3CH2CH2Cho, se on 2475 kJ/mol. Tämä lämpö on korkeampi kuin 2-butanoni, CH3CH2Kokki3, joka on yhtä suuri kuin 2442 kJ/mol. Siksi butanal on epävakaampi kuin 2-butanoni.
2-butanonissa C = O on stabiloitumpi ryhmien C-ansiosta3CH2 ja ch3; Asia, jota ei tapahdu butaanilla, missä yksi ryhmistä on tuskin atomi h.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Palamislämpö. Haettu: vuonna.Wikipedia.org
- CK-12-säätiö. Palamislämpö. Kemian librettexts. Palautettu: Chem.Librettexts.org
- BBC. (2020). Kemiallinen energia: palamisen entalpia. Haettu osoitteesta: BBC.yhteistyö.Yhdistynyt kuningaskunta
- Steven a. Kovettuja. (2017). Orgaanisen kemian kuvitettu sanasto: palamisen entalpia. Palautettu: Chem.UCLA.Edu

