Ammoniumkarbonaatti ((NH4) 2CO3)
- 4002
- 379
- Gabriel Fahey
Mikä on ammoniumkarbonaatti?
Hän Ammoniumkarbonaatti Se on epäorgaaninen typpisuola, erityisesti ammoniacal, jonka kemiallinen kaava on (NH4-A2Yhteistyö3. Sitä kehitetään synteesimenetelmillä, joista on syytä käyttää ammoniumsulfaatin ja kalsiumkarbonaatin seoksen sublimointia: (NH4-A2Sw4(s)+ caco3(s) => (NH4-A2Yhteistyö3(s)+ tapaus4(S).
Yleensä ammoniumsuolat ja kalsiumkarbonaatti lämmitetään astiassa ammoniumkarbonaatin aiheuttamiseksi. Teollisuusmenetelmä, joka tuottaa tonnia tätä suolaa.
Ammoniumia, hiilidioksidia ja vettä sisältävät höyryt tiivistetään ammoniumkarbonaattikiteiden muodostamiseksi: 2NH3(g)+ h2Tai (l) + Co2(g) → (NH4-A2Yhteistyö3(S). Reaktiossa hiilihappoa esiintyy, h2Yhteistyö3, Hiilidioksidin liuottamisen jälkeen veteen, ja juuri tämä happo tuottaa kaksi protoniaan, H+, kahdelle ammoniakkimolekyylille.
Ammoniumkarbonaattiominaisuudet
 Ammoniumkarbonaatin ulkonäkö
Ammoniumkarbonaatin ulkonäkö Se on valkoinen, kiteinen ja väritön kiinteä, ja siinä on voimakkaita hajuja ja ammoniakkia. Sulaa 58 °: seen.
Tämä hajoaminen tapahtuu kuitenkin kahdessa vaiheessa: ensin NH -molekyyli vapautuu3, Ammoniumbikarbonaatin tuottaminen (NH4HCO3) Ja toiseksi, jos lämmitys jatkuu, karbonaatti on suhteettomia.
Se on kiinteä liukeneminen veteen ja vähemmän liukoista alkoholiin. Muodosta vety siltoja vedellä ja kun 5 grammaa liukenee 100 grammaan vettä, se tuottaa emäksisen liuoksen, jonka pH on noin 8,6.
Voi palvella sinua: emulgoija: emulsioprosessi, molekyyliset näkökohdat, sovelluksetSen korkea affiniteetti veteen on valmistettu hygroskooppisella kiinteällä aineella (se imee kosteutta), ja siksi sitä on vaikea löytää sen anhydridimuodossa. Itse asiassa sen monohydraattimuoto (NH4-A2Yhteistyö3· H2O), on yleisin kaikista ja selittää kuinka suola on ammoniakkikaasun kantaja, aiheuttaen hajua.
Ilmassa se hajoaa tuottamaan ammoniumbikarbonaattia ja ammoniumkarbonaattia (NH4Nh2Yhteistyö2-A.
Kemiallinen rakenne
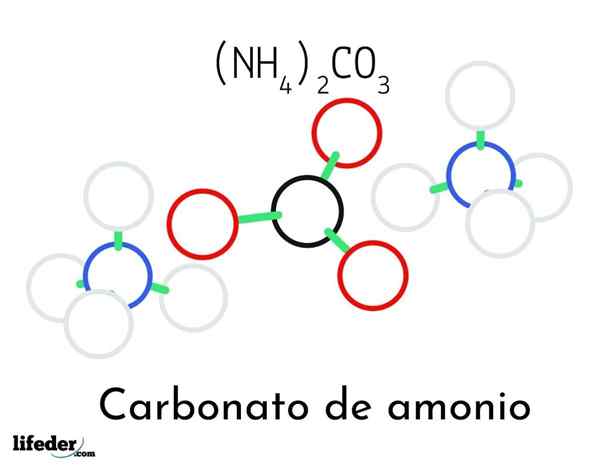
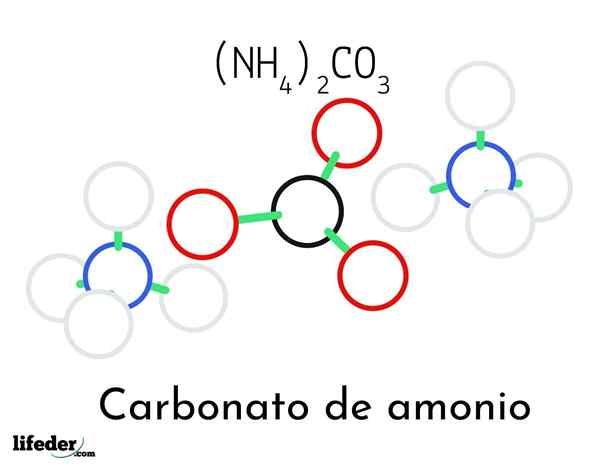
 Ammoniumkarbonaattirakenteen malli; Kaksi ammoniumia ja yksi karbonaattikationi
Ammoniumkarbonaattirakenteen malli; Kaksi ammoniumia ja yksi karbonaattikationi Ylemmässä kuvassa havainnollistetaan ammoniumkarbonaatin kemiallinen rakenne. Keskellä on anion co32-, litteä kolmio mustalla keskustalla ja punaisella palloilla; Ja sen molemmille puolille, Ammonios NH -kationit4+ tetraedriset geometriat.
Ammoniumionigeometria selitetään SP -hybridisaatiolla3 typpiatomilla, tilaamalla vetyatomeja (valkoisia palloja) sen ympärille tetraedron muodossa. Kolmen ionin joukosta perustetaan vety sillat (H3N-H-O-CoS22--A.
Geometriansa ansiosta yksi co -anion32- voi muodostaa jopa kolme vety sillaa; kun taas NH -kationit4+ Ehkä he eivät voi muodostaa vastaavia neljää vetysilmaa heidän positiivisten varaustensa sähköstaattisten torjumien takia.
Kaikkien näiden vuorovaikutusten tulos on ortorromisen järjestelmän kiteytyminen. Miksi se on niin hygroskooppinen ja vesiliukoinen? Vastaus on samassa edellisessä kappaleessa: vety sillat.
Nämä vuorovaikutukset ovat vastuussa anhydridisuolan nopeasta veden imeytymisestä muodostettavaksi (NH4-A2Yhteistyö3· H2JOMPIKUMPI). Tämä johtaa muutoksiin ionien alueellisessa järjestelyssä ja siten kiteisessä rakenteessa.
Se voi palvella sinua: nikkelikloridi (NICL2): rakenne, ominaisuudet, hankkiminen, käyttöRakenteelliset uteliaisuudet
Ei ole väliä kuinka yksinkertainen (NH näyttää4-A2Yhteistyö3, Se on niin herkkä lukemattomille muutoksille, että sen rakenne on mysteeri. Tämä rakenne vaihtelee myös kiteisiin vaikuttavien paineiden mukaan.
Jotkut kirjoittajat ovat havainneet, että ionit on tilattu vety silloilla vuorattuina koplaaneina (ts. Ketju NH -sekvenssillä4+-Yhteistyö32--…), Jossa vesimolekyylit todennäköisesti toimivat liittiminä muihin ketjuihin.
Vielä enemmän, ylittäen maanpäällisen taivaan, miten nämä kiteet ovat alueellisissa tai tähtienvälisissä olosuhteissa? Mitkä ovat koostumuksesi hiilihapotettujen lajien stabiilisuuden suhteen? On tutkimuksia, jotka vahvistavat näiden kiteiden suuren stabiilisuuden planeetta- ja komeetta jään massoille.
Tämä antaa heille mahdollisuuden toimia hiili-, typpi- ja vetyvarastoina, jotka saavat aurinkosäteilyä, voidaan muuttaa orgaaniseksi materiaaliksi, kuten aminohapoiksi.
Toisin sanoen nämä jäätelöammoniakkiset lohkot voisivat olla "elämän koneiden aloittavan pyörän kantajat" kosmosissa. Näistä syistä heidän kiinnostuksensa astrobiologian ja biokemian alaan kasvaa.
Käyttää/sovelluksia
Sitä käytetään leuerina, koska lämmittäminen tuottaa hiilidioksidia ja ammoniumkaasuja. Ammoniumkarbonaatti on, jos haluat, modernin leivinjauheen edeltäjä, ja sitä voidaan käyttää keksejen ja litteiden keksien leipomiseen.
Sen käyttöä kakkujen leipomiseen ei kuitenkaan suositella. Kakkien paksuuden vuoksi ammoniumkaasut säilytetään sisäpuolella ja tuottavat epämiellyttävän maun.
Se voi palvella sinua: syklohexen: rakenne, ominaisuudet, synteesi ja käyttöSitä käytetään odotustena, toisin sanoen lievitetään yskimistä, kun keuhkoputket. Sillä on sienitautien toimenpide, joka käyttää tästä syystä maataloudessa. Se on myös elintarvikkeiden happamuuden säätelijä ja sitä käytetään orgaanisessa urean synteesissä korkeissa paineissa ja hidantoinasissa.
Riskejä
Ammoniumkarbonaatti on erittäin myrkyllistä. Se tuottaa ihmisillä akuutin suuontelon ärsytyksen, kun se on yhteydessä.
Lisäksi, jos nielty aiheuttaa mahalaukun ärsytystä. Samanlainen vaikutus havaitaan ammoniumkarbonaatille alttiissa silmissä.
Suolan hajoamiskaasujen hengittäminen voi ärsyttää nenää, kurkkua ja keuhkoja, aiheuttaen yskää ja hengitysvaikeuksia.
Akuutti koiran altistuminen ammonaatti -ammonaatilla annoksella 40 mg/kg painoa, aiheuttaa oksentelua ja ripulia. Suurimmat ammoniumkarbonaatin annokset (200 mg/kg painoa) ovat yleensä tappavia. Sydänvaurio on osoitettu kuolinsyyksi.
Jos sitä lämmitetään erittäin korkeissa lämpötiloissa ja happea rikastettussa ilmassa, se antaa myrkyllisiä kaasuja2.
Viitteet
- Pubchem. (2018). Ammoniumkarbonaatti. Haettu 25. maaliskuuta 2018, PubChem: Pubchem.NCBI.Nlm.NIH.Hallitus
- Orgaaninen kemian portaali. ((2009-2018)). Bucherer-Bergs-reaktio. Haettu 25. maaliskuuta 2018 orgaanisen kemian portaalista: www.Orgaaninen kemia.org
- Wikipedia. (2018). Ammoniumkarbonaatti. Haettu 25. maaliskuuta 2018 Wikipediasta:.Wikipedia.org
- Kemian yritys. (2018). Kemian yritys. Haettu 25. maaliskuuta 2018 kemikaaliyhtiöltä: Thechemco.com