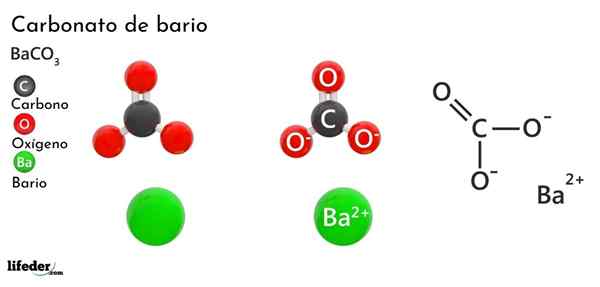
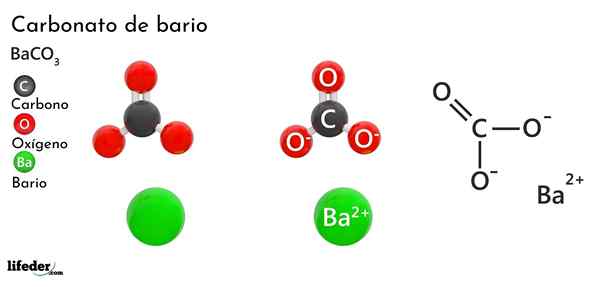
Bariumkarbonaatti (BACO3)
- 4142
- 958
- Louis Moen
Mikä on bariumkarbonaatti?
Hän bariumkarbonaatti Se on epäorgaaninen suola metallibariosta, jaksollisen taulukon ryhmän 2 viimeisimmästä elementistä ja joka kuuluu alkalinottimiin metalleihin. Sen kemiallinen kaava on Bacchus3 Ja sitä on saatavana markkinoilla valkoisen kiteisen pölyn muodossa.
Kuinka se saadaan? Metalli bariumia löytyy mineraaleista, kuten bariitti (baso4) ja valkoisempi (Bacchus3-A. Valkoisempi liittyy muihin mineraaleihin, jotka pysyvät puhtaita tasoja sen valkoisiin kiteisiin vastineeksi värien puolesta.
Tuottaa Bacchus3 synteettisen käytön on välttämätöntä eliminoida valkoisemman epäpuhtaudet, kuten seuraavat reaktiot osoittavat:
Bacchus3(s, epäpuhdas) + 2nh4Cl (s) + Q (lämpö) => BACL2(aq) + 2nh3(g) + h2Tai (l) + Co2(g)
Bacl2(aq) + (NH4-A2Yhteistyö3(s) => bacchus3(s) + 2nh4Cl (AQ)
Barita on kuitenkin bariumin tärkein lähde, ja siksi bariumyhdisteiden teollisuustuotannot alkavat tästä. Tämä mineraali syntetisoi bariumsulfidia (BAS), tuotteen, josta muiden yhdisteiden ja Bacchus -virtojen synteesi3-
Bas (s) + na2Yhteistyö3(s) => bacchus3(s) + na2HH)
Bas (s) + co2(g) + h2Tai (l) => bacchus3(s) + (NH4-A2S (aq)
Bario -karbonaattiominaisuudet
 Bariumkarbonaattipöly
Bariumkarbonaattipöly Se on pölyinen, valkoinen ja kiteinen. Se on wc, purkautuva ja sen molekyylipaino on 197,89 g/mol. Sen tiheys on 4,43 g/ml ja ei -olemassa olevaa höyrynpainetta.
Sen taitekorut ovat 1 529, 1 676 ja 1 677. Witherita säteilee valoa, kun se absorboi ultraviolettisäteilyä: kirkkaan valkoisesta valosta, jossa on sinertäviä sävyjä, keltaiseen valoon.
Se on erittäin liukenematon veteen (0,02 g/l) ja etanolissa. HCL -happoliuokset muodostavat liukoisen bariokloridisuolan (BACL2), joka selittää sen liukoisuuden näihin happamiin väliaineisiin. Rikkihapon tapauksessa saostuu kuinka liukenematon suola -emäs4.
Voi palvella sinua: berylioksidi (BEEO)Bacchus3(s) + 2HCl (aq) => BACL2(aq) + co2(g) + h2Tai (l)
Bacchus3(s) + h2Sw4(aq) => baso4(s) + Co2(g) + h2Tai (l)
Koska se on ioninen kiinteä, se on myös liukenematon apolaarisiin liuottimiin. Bariumkarbonaatti sulaa 811 ºC: n nopeudella; Jos lämpötila nousee noin 1380-1400 ºC, suolainen neste kärsii kemiallisesta hajoamisesta kiehumisen sijasta. Tämä prosessi tapahtuu kaikille metallikarbonaateille: MCO3(s) => mo (s) + Co2(g).
Lämpöhajoamisen
Bacchus3(s) => bao (s) + co2(g)
Jos ionisille kiinteille aineille on ominaista erittäin vakaa, miksi karbonaatit hajoavat? Muuttaako metalli lämpötilaa, jossa kiinteä aine hajoaa? Ionit, jotka muodostavat bariumkarbonaatin, ovat BA2+ ja yhteistyökumppani32-, Molemmat tilaa vievät (ts. Suurten ionisten radioiden kanssa). Yhteistyökumppani32- Hän on vastuussa hajoamisesta:
Yhteistyö32-(s) => o2-(g) + Co2(g)
Oksidi -ioni (tai2-) Metalli on kytketty metalliin, metallioksidiin. MO tuottaa uuden ionisen rakenteen, jossa yleensä sen ionien koko on samankaltainen, sitä vakaampi tuloksena oleva rakenne (verkon entalpia). Päinvastoin tapahtuu, jos ionit m+ Minä2- Heillä on erittäin epätasa -arvoinen ioniradio.
Jos verkon entalpia on suuri, hajoamisreaktio on energisesti suosittu, mikä vaatii alhaisempia lämmityslämpötiloja (alhaisemmat kiehumispisteet) vähäiset).
Toisaalta, jos MO: lla on pieni verkon entalpia (kuten Baon tapauksessa, missä BA2+ Sillä on suurempi ioniradio kuin tai2-) Hajoaminen on vähemmän suosittu ja vaatii korkeampia lämpötiloja (1380-1400ºC). Mgco -tapauksissa3, Varas3 ja Srco3, Ne hajoavat alhaisemmissa lämpötiloissa.
Voi palvella sinua: Magnesium: historia, rakenne, ominaisuudet, reaktiot, käyttötarkoituksetKemiallinen rakenne
Anion co32- Sillä on kaksoissidosresonoiva kolmen happiatomin välillä, kaksi näistä negatiivisesti varautuneista kationin houkuttelemiseksi2+.
Vaikka molempia ioneja voidaan pitää ladattuina palloina, CO32- Siinä on tasainen trigonaalinen geometria (kolmen happiatomin piirtämä litteä kolmio), mahdollisesti BA: n negatiivinen "tyyny"2+.
Nämä ionit ovat vuorovaikutuksessa sähköstaattisesti ortorromisten tyypin kiteisen järjestelyn muodostamiseksi, koska ne ovat pääosin ionisia sidoksia.
Siinä tapauksessa miksi Bacchus ei liukene3 Vedessä? Selitys perustuu yksinkertaisesti siihen tosiasiaan, että ionit stabiloivat paremmin kiteisessä verkossa, kuin pallomaiset molekyylikerrokset vettä.
Toisesta kulmasta vesimolekyylit vaikeuttavat vahvojen sähköstaattisten nähtävyyksien voittamista kahden ionin välillä. Näissä kiteisissä verkoissa he voivat sijoittaa epäpuhtauksia, jotka antavat väriä valkoisille kiteille.
Sovellukset
Ensi silmäyksellä Bacchus -osa3 Se ei välttämättä lupaa käytännöllistä sovellusta jokapäiväisessä elämässä, mutta jos on olemassa valkoisemman mineraalin, valkoisen kuin maito, on järkevää, miksi sen taloudellinen kysyntä.
Käytetään bariumlasin valmistukseen tai lisäaineena niiden vahvistamiseksi. Sitä käytetään myös optisen lasin valmistuksessa.
Suuren verkon ja liukenemattomuuden entalpiansa vuoksi sitä käytetään erityyppisten seosten, kumien, venttiilien, lattioiden lattioiden, maalausten, keramiikan, voiteluaineiden, muovien, rasvojen ja -sementtien valmistukseen valmistuksessa.
Sitä käytetään myös hiirille. Yhteenvetona voidaan todeta,.
Voi palvella sinua: sulfanyylihappo: rakenne, ominaisuudet, synteesi, käyttääBacchus3 Se voidaan syntetisoida nanohiukkasiksi, mikä ilmaisee hyvin pienet asteikot uudet mielenkiintoiset ominaisuudet valkoisemmasta. Näitä nanohiukkasia käytetään metallipintojen läpäisemiseen, erityisesti kemiallisiin katalyytteihin.
Sen on havaittu parantavan hapetuskatalyyttejä ja että jotenkin suosii happimolekyylien kulkeutumista sen pinnalla.
Niitä pidetään työkaluina nopeuttaakseen prosesseja, joissa happi on sisällytetty. Ja lopuksi niitä käytetään syntetisoimaan supramolekulaarisia materiaaleja.
Riskejä
Bacchus3 Se on myrkyllistä nielemisen vuoksi, aiheuttaen epämiellyttävien oireiden äärettömyyden, joka johtaa kuolemaan johtuen hengitysvajeista tai sydämenpysähdyksestä; Tästä syystä ei ole suositeltavaa kuljettaa syötävien tavaroiden vieressä.
Se tuottaa silmien ja ihon punoitusta yskän ja kurkkukivun lisäksi. Se on myrkyllistä yhdiste.
Se ei ole syttyvä, mutta korkeissa lämpötiloissa se hajoaa muodostaen Baon ja CO: n2, Myrkyllisiä ja hapettavia tuotteita, jotka voivat saada muut materiaalit palamaan.
Organismissa barium on talletettu luihin ja muihin kudoksiin, korostaen kalsiumia monissa fysiologisissa prosesseissa. Se estää myös kanavat, joissa k -ionit matkustavat+, estämällä sen diffuusion solukalvojen kautta.
Viitteet
- Pubchem. (2018). Bariumkarbonaatti. Haettu 24. maaliskuuta 2018, Pubchem: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2017). Bariumkarbonaatti. Haettu 24. maaliskuuta 2018 Wikipediasta:.Wikipedia.org
- Kemikaalikirja. (2017). Bariumkarbonaatti. Haettu 24. maaliskuuta 2018, Chemicalbook: Chemicalbook.com
- Robbins Manuel a. (1983).Robbins keräilijän fluoresoivien mineraalien kirja. Fluoresoivat mineraalit Kuvaus, P-117.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Sisään Yksinkertaisten kiintoaineiden rakenne (Neljäs painos., p. 99-102). MC Graw Hill.