Natriumkarbonaatti (NA2CO3)
- 3430
- 392
- Juan Breitenberg V
Selitämme, mikä natriumkarbonaatti, sen fysikaaliset ja kemialliset ominaisuudet, rakenne ja sovellukset ovat
 Natriumkarbonaattirakenne ja kaava
Natriumkarbonaattirakenne ja kaava Mikä on natriumkarbonaatti?
Hän Sooda (NA2Yhteistyö3) Se on epäorgaaninen suola, emäksinen metalli ja hiilihappo. Hänet tunnetaan myös maailmanlaajuisesti nimellä Sosa Ash. Järvet ja vulkaaniset aktiivisuudet rikastuttivat natriumin maaperää, joista kasveja ravittiin; Sitten tulipalon jälkeen nämä kasvit levittivät karbonaattituhkaa.
Kuinka tämä metallinen natriumsuola syntyy? Puhtaalla natriumilla on Valencia -konfiguraatio [NE] 3S1. 3S -kiertoradan elektroni1 Se irrottaa helposti muut luonnon elementit (kuten rikki, happi, kloori, fluori jne.), muodostaa mineraaliyhdisteitä, joihin stabiili ioni na osallistuu+.
Sitten eräs+ Siinä on muut ioniset lajit näissä kiinteissä aineissa; Näistä natriumkarbonaatti on vain yksi luonteeltaan läsnä oleva. Siitä lähtien sitä on käytetty kaikissa sivilisaatioissa koko ajan. Nämä sivilisaatiot havaitsivat, että harmaata pölyä hyödyllisiä ominaisuuksia koteihinsa ja ihmisiin.
Nämä ominaisuudet merkitsivät käyttötarkoituksiaan, jotka nykyään ylläpitävät perinteisiä näkökohtia menneisyydessä, ja muut vastaavat nykyiset tarpeet.
Natriumkarbonaatti on luonteeltaan erittäin runsaasti, ja ehkä myös muilla alueilla maan planeetan ulkopuolella, kuten jotkut aurinkokunnan kuutista.
Kaava
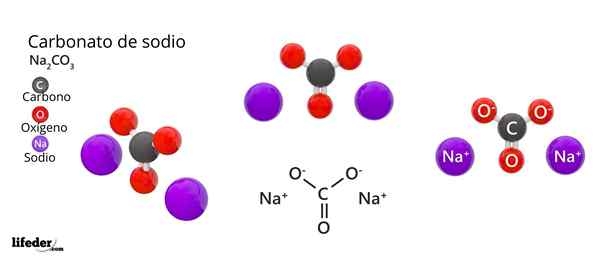
Natriumkarbonaatin kemiallinen kaava on NA2Yhteistyö3. Kuinka sitä tulkitaan? Se tarkoittaa, että kiteisessä kiinteässä aineessa jokaiselle yhteistyölle32- NA -ionia on kaksi+.
Natriumkarbonaattirakenne
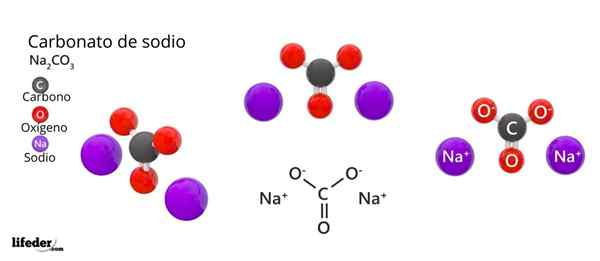
Yläkuvassa NA: n rakenne on edustettuna2Yhteistyö3 Anhydridi (kutsutaan myös Sosa Calcinada). Violetti pallot vastaavat Na -ioneja+, kun taas musta ja punainen ionit Co: lle32-.
Karbonaatti -ioneilla on tasainen trigonaalinen rakenne, happiatomien kanssa niiden kärjessä.
Se voi palvella sinua: Cinamiinihappo: rakenne, ominaisuudet, hankkiminen, käyttöKuva antaa panoraaman nähtynä korkeammasta tasosta. Na -ionit+ Niitä ympäröivät kuusi happiatomia, yhteistyöistä32-. Eli NA: ssa2Yhteistyö3 Anhydridi Natrium kohtaa oktaedrisen koordinaation geometrian (se on lukittu oktaedron keskelle).
Tämä rakenne pystyy kuitenkin myös sijoittamaan vesimolekyylejä, vuorovaikutuksessa vety silloilla kolmioiden kärkien kanssa.
Itse asiassa Na hydraatit2Yhteistyö3 (NA2Yhteistyö3· 10H2Tai, na2Yhteistyö3· 7H2Tai, na2Yhteistyö3· H2Tai ja muut) ovat runsaasti kuin anhydridisuola.
Termonatriitti (na2Yhteistyö3· H2O), Natron (na2Yhteistyö3· 10H2O) ja trona (na3(HCO3) (CO3) · 2h2Tai ovat tärkeimmät luonnolliset natriumkarbonaatin lähteet, erityisesti Trona -mineraali, esitetty ensimmäisessä kuvassa.
KÄYTTÖ/Natriumkarbonaatin sovellus
Natriumkarbonaatti suorittaa lukuisia toimintoja ihmisissä, kotitalouksissa ja teollisuudessa, näiden toimintojen joukossa seuraava erottuva:
- Natriumkarbonaattia käytetään lukuisissa puhdistustuotteissa. Tämä johtuu sen desinfiointiaineesta, sen voimasta liuottaa rasvoja ja omaisuuttaan veden pehmentämiseksi. Se on osa pesuaineita, joita käytetään pesulissa, automaattisessa astianpesukoneessa, puhdasta lasia, sekoittajia, valkaisuaineita jne.
- Karbonaatti -desinfiointiainetta voidaan käyttää muilla kuin risteillä kovilla pinnoilla, kuten lattiat, seinät, posliinit ja kylpyammeet, lukuun ottamatta Lasikuitu ja alumiini, jonka hän voi raaputtaa.
- Sitä käytetään joissakin elintarvikkeissa, jotta vältetään kuppi, jota voi esiintyä näissä.
- Sitä esiintyy useissa henkilökohtaisen hygienian tuotteissa, kuten kuplakylpy, hammaspasta ja saippuat.
- Sitä käytetään lasiteollisuudessa sen kyvyn hajottamisen vuoksi.
- Sitä käytetään uima -altaiden ylläpidossa, missä se täyttää pH: n desinfiointiaineen ja sääntelytoiminnan.
- Ihmisillä, joita käytetään terapeuttisesti happamuuden ja dermatiitin hoidossa.
- Eläinlääketieteessä sitä käytetään sidan ja ihonpuhdistuksen hoidossa.
Natriumkarbonaattisynteesi

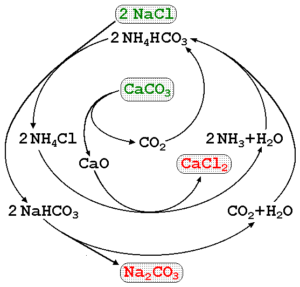
Natriumkarbonaatti voidaan valmistaa käyttämällä merivettä ja kalkkikiveä (Caco3) Solvay -prosessissa. Ylemmässä kuvassa kuvataan prosessikaavio, joka osoittaa tuotantoreittejä, samoin kuin reagenssit, välittäjät ja tuotteet. Reagenssit on kirjoitettu vihreällä kirjaimella ja tuotteilla punaisella kirjaimella.
Näiden reaktioiden seuranta voi olla hiukan monimutkainen, mutta globaali yhtälö, joka osoittaa vain reagenssit ja tuotteet, on:
2nacl (aq) + caco3(s) na2Yhteistyö3(s) + cacl2(AC)
Caco3 Sillä on erittäin vakaa kiteinen rakenne, joten se vaatii jatkuvasti paljon energiaa sen hajottamiseksi CO: ssa2. Lisäksi tämä prosessi tuottaa suuria määriä CACL: tä2 (Kalsiumkloridi) ja muut epäpuhtaudet, joiden päästöt vaikuttavat veden ja ympäristön laatuun.
Teollisuusaloilla on myös muita natriumkarbonaattituotantomenetelmiä, kuten HOU- ja LeBlanc -prosesseja.
Nykyään sen hankkiminen sen luonnollisista mineraaleista on kestävää, Trona on kaikkein runsas näistä.
Toisaalta perinteisin menetelmä koostui kasvien viljelystä ja polttamisesta ja natriumissa olevista leväistä. Sitten tuhka kylpettiin vedellä ja lämmitettiin tuotteeseen saakka. Täältä nousi Sosan kuuluisat tuhkan.
Natriumkarbonaattiominaisuudet
Sitten eräs2Yhteistyö3 Se on hygroskooppinen valkoinen kiinteä aine, wc, jonka molekyylipaino on 106 g/mol ja tiheys 2,54 g/ml 25 ° C: ssa.
Sen ominaisuudet muuttuvat, kun vesimolekyyli sisältyy kiteiseen rakenteeseensa. Koska vesi voi muodostaa vety silloja ja ionit "avoin tila" niiden välillä, lasin tilavuus kasvaa ja hydraatin tiheys pienenee. Esimerkiksi NA: lle2Yhteistyö3· 10H2Tai sen tiheys on 1,46 g/ml.
Voi palvella sinua: palautuva reaktio: Ominaisuudet ja esimerkitSitten eräs2Yhteistyö3 sulaa 851 ºC: n nopeudella, hajoaa seuraavan yhtälön mukaan:
Naa2Yhteistyö3(s) => na2Tai (s) + Co2(g)
Jälleen, huolimatta Co -ioneista32- ja na NA+ Ne eroavat koot, niiden sähköstaattiset vuorovaikutukset ovat erittäin tehokkaita ja ylläpitävät stabiilia kiteistä verkkoa.
Vesimolekyylit "estävät" näitä vuorovaikutuksia ja seurauksena hydraatit ovat alttiimpia hajoamiselle kuin anhydridi.
Se on perussuola; toisin sanoen liuenneen veteen tuottaa liuoksen, jonka pH on yli 7. Tämä johtuu CO: n hydrolyysistä32-, jonka reaktio vapauttaa OH- keskellä:
Yhteistyö32-(AC) + H2Tai (l) HCO3-(AC) + OH-(AC)
Se on erittäin liukoinen vesi- ja polaarisiin liuottimiin, kuten glyseroliin, glyseriiniin, asetoniin, asetaateihin ja nestemäisiin ammoniakkiin.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Ryhmän 1 elementeissä. (Neljäs painos., p. 265). MC Graw Hill.
- Scifun.org. (2018). Natriumvetykarbonaatti ja natriumkarbonaatti. Scifunista toipunut.org
- Wikipedia. (2018). Sooda. Haettu jstk.Wikipedia.org
- Pubchem. (2018). Sooda. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus
- Ciner Resources Corporation. (2018). Soodatuhka. Ciner toipui.meille.com
- Peltier k. (3. heinäkuuta 2018). Kaikki mitä sinun tarvitsee tietää natriumkarboniitista. Haettu 8. huhtikuuta 2018, Lähettäjä: theSpruce.com
- Nettoteollisuus. (2018). Natriumkarbonaatti - Natriumkarbonaatin käyttö. Haettu 8. huhtikuuta 2018: science.jankki.org

