Hiili

- 3848
- 840
- Ronald Reilly
Mikä on hiili?
Hän hiili Se on ei -metallinen kemiallinen elementti, jonka kemiallinen symboli on c. Sen nimi johtuu hiilestä, vihannesta tai mineraalista, missä sen atomit määrittelevät erilaisia rakenteita. Se muodostaa laajan valikoiman orgaanisia ja epäorgaanisia yhdisteitä ja esittelee myös huomattavan määrän alotrooppeja.
Hiiltä löytyy kaikista elävistä olennoista; Kaikki sen biomolekyylit ovat olemassa olemassaolonsa C-C-sidosten stabiilisuudelle ja voimakkuudelle sekä sen korkealle taipumukselle ketjuttamaan. Se on elämän elementti, ja heidän atomiensa kanssa heidän ruumiinsa on rakennettu.
Orgaaniset yhdisteet, joiden kanssa biomateriaalit rakennetaan. Ne voidaan nähdä ensi silmäyksellä puiden puusta; Ja myös kun salama putoaa heille ja Rostiza. Jäljellä olevassa inertissä mustassa kiinteissä kiinteissä kiinteissä kiinteissä kiinteissä kiinteissä kiinteissä kiinteissä aineissa on myös hiiltä; Mutta se on vihanneshiili.
Hiilen ominaisuudet
Kiinteissä aineissa, mineraaleissa tai hiilipitoisissa materiaaleissa löydetyt fysikaaliset tai kemialliset ominaisuudet ovat monissa muuttujissa. Niiden joukossa ovat: epäpuhtauksien koostumus tai aste, hiiliatomien hybridaatiot, rakenteiden monimuotoisuus ja huokosten morfologia tai koko.
Kun hiilen ominaisuudet kuvaavat, suurin osa bibliografisista teksteistä tai lähteistä perustuu grafiittiin ja timanttiin.
Koska? Koska ne ovat tunnetuimpia alotrooppeja tälle elementille ja edustavat kiinteitä aineita tai erittäin puhtaita materiaaleja; toisin sanoen niistä tehdään käytännössä muuta kuin hiiliatomeja (vaikkakin erilaisilla rakenteilla, kuten seuraavassa osassa selitetään).
Vihannes- ja mineraalihiilen ominaisuudet eroavat vastaavasti alkuperästään tai koostumuksistaan. Esimerkiksi ligniitti (huono hiili) Gatea -polttoaineena antrasiittiin verrattuna (hiilirikas). Ja mitä sanotaan muista alotropeista: nanoputket, fullerenos, grafeeni, graphos jne.
Niillä on kuitenkin kemiallisesti yhteinen kohta: ne hapettuu ylimääräisellä happea CO: ssa2-
C + JOMPIKUMPI2 => Co2
Nyt nopeus tai lämpötila, jota he tarvitsevat hapettumiseen.
Grafiitti vs. timantti
Tässä on myös lyhyt kommentti näiden kahden alotroopin eri ominaisuuksista:
 Taulukkoa, joissa verrataan kahden kiteisen alotropin joitain ominaisuuksia. Lähde: Gabriel Bolívar.
Taulukkoa, joissa verrataan kahden kiteisen alotropin joitain ominaisuuksia. Lähde: Gabriel Bolívar. Elektroninen rakenne ja kokoonpano
Hybridaatiot
 Hybridi -kiertoratojen ja hiilen mahdollisten rakenteiden välinen suhde. Lähde: Gabriel Bolívar.
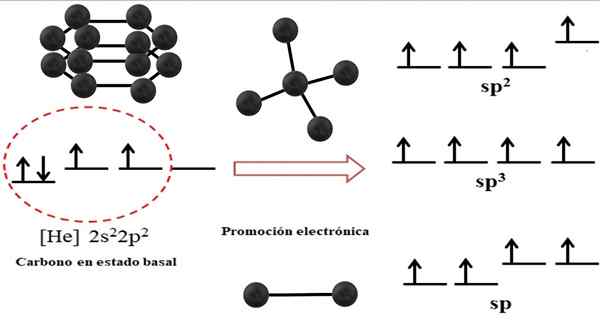
Hybridi -kiertoratojen ja hiilen mahdollisten rakenteiden välinen suhde. Lähde: Gabriel Bolívar. Hiiliatomin elektroninen kokoonpano on 1s22s22 p2, kirjoitettu myös nimellä [he] 2s22 p2 (Yläkuva). Tämä esitys vastaa sen perustilaa: hiiliatomi eristetty ja suspendoitu sellaiseen tyhjiöön, joka ei voi olla vuorovaikutuksessa muiden kanssa.
Voi palvella sinua: Kristillinen rakenneOn arvostettu, että yhdellä sen 2P -kiertoradalla ei ole elektroneja, mikä hyväksyy pienemmän energian kiertoradan elektronin elektronisella edistämisellä; Ja siten atomi saa kyvyn muodostaa jopa neljä kovalenttisia sidoksia sen neljän SP -hybridi -kiertoradan kautta3.
Huomaa, että neljä orbitaalia sp3 Ne rappeutuvat energiassa (kohdistettu samalla tasolla). Orbitaalit p Puhtaat ovat energisempiä, minkä vuoksi ne ovat muiden hybridi -kiertoratojen yläpuolella (kuvan oikealla puolella).
Jos hybridi -orbitaalit ovat kolme, se johtuu siitä, että kiertoradalla on p ilman hybridisointia; Siksi ne ovat kolme SP -kiertorataa2. Ja kun näitä hybridi -kiertoratoja on kaksi, kaksi kiertorataa p Niitä on saatavana kaksois- tai kolminkertaisten sidosten muodostamiseksi, mikä on F -hiilen hybridisaatio.
Tällaiset elektroniset näkökohdat ovat välttämättömiä ymmärtämään, miksi hiili löytyy alotropien äärettömyydestä.
Hapetusluvut
Ennen rakenteiden jatkamista ei ole muuta mainita, että Valencia 2S: n elektroninen kokoonpano22 p2, Hiilellä voi olla seuraavat hapettumisnumerot: +4, +2, 0, -2 ja -4.
Koska? Nämä numerot vastaavat olettamusta, että ioninen sidos on siten, että muodostat ionit vastaavilla kuormilla; eli c4+, C2+, C0 - (neutraali), c2- ja c4-.
Jotta hiilellä olisi positiivinen hapettumisnumero, sen on menetettävä elektronit; Ja sen tekemiseksi se on välttämättä liitettävä erittäin elektronegatiivisiin atomiin (kuten happea).
Samaan aikaan, jotta hiilellä olisi negatiivinen hapettumisluku, sen on saatava elektroneja, jotka yhdistävät metalliin tai vähemmän elektronegatiivisia atomeja kuin hän (kuten vety).
Ensimmäinen hapetuskysymys, +4, tarkoittaa, että hiili on menettänyt kaikki valenssielektronit; Orbitaalit 2s ja 2p ovat tyhjiä. Jos 2P: n kiertorata menettää kaksi elektroniaan, hiilellä on +2 hapettumisnumero; Jos voitat kaksi elektronia, sinulla on -2; Ja jos hän voittaa kaksi elektronia, jotka täydentävät hänen oktettinsa Valenciasta, -4.
Esimerkit
Esimerkiksi CO: lle2 Hiilen hapettumisnumero on +4 (koska happi on enemmän elektronegatiivista); kun taas cho4, on -4 (koska vety on vähemmän elektronegatiivinen).
Voi palvella sinua: hydratsiini: rakenne, ominaisuudet, synteesi, käyttöCH: lle3Voi, hiilen hapettumisnumero on -2 (+1 H: lle ja -2 O: lle); HCOOH: n suhteen se on +2 (tarkista, että summa 0).
Muut hapetustilat, kuten -3 ja +3, ovat myös todennäköisiä, etenkin kun kyse on orgaanisista molekyyleistä; Esimerkiksi metyyliryhmissä -CH3.
Molekyyligeometriat
Ylivoimaisessa kuvassa ei osoitettu vain hiiliatomin kiertoratojen hybridisaatiota, vaan myös tuloksena olevat molekyyligeometriat, kun useita atomeja (mustia palloja) on kytketty keskeiseen. Tällä keskellä atomilla tiettyjen geometrisen ympäristön hävittämiseksi avaruudessa on oltava vastaava kemiallinen hybridisaatio, joka on sallittua.
Esimerkiksi tetraedrille keskushiilellä on SP -hybridisaatio3; Koska sellainen on vakain järjestely neljälle hybridi -SP: lle3. SP -hiilihiilissä2, Ne voivat muodostaa kaksoislinkkejä ja hävittää trigonaalisen tasaisen ympäristön; Ja niin, nämä kolmiot määrittelevät täydellisen kuusikulmion. Ja SP -hybridisaatiota varten hiilit omaksuvat lineaarisen geometrian.
Siten kaikkien alotrooppien rakenteissa havaitut geometriat säädetään yksinkertaisesti tetraedrassa (SP3), heksagonit tai pentagonit (SP2) ja viivat (sp).
Tetrahedra määrittelee 3D -rakenteen, kun taas heksagonit, pentagonit ja viivat, 3D- tai 2D -rakenteet; Jälkimmäiset tulevat tason tai arkkien, jotka ovat samanlaisia kuin mehiläisten hunajakennojen seinät:
 Seinä mehiläisen hunajakennon kuusikulmaisilla malleilla analogisesti SP2 -hiilihiilistä koostuville tasoille. Lähde: Pixabay.
Seinä mehiläisen hunajakennon kuusikulmaisilla malleilla analogisesti SP2 -hiilihiilistä koostuville tasoille. Lähde: Pixabay. Ja jos taitamme tämän kuusikulmaisen seinän (pentagonaali tai sekoitettu), saamme putken (nanoputket) tai pallon (fullereeni) tai muun kuvan. Näiden lukujen väliset vuorovaikutukset aiheuttavat erilaisia morfologioita.
Amorfinen tai kiteinen kiinteä aine
Mahdollisten hiilirakenteiden geometriat, hybridisaatiot tai morfologiat, niiden kiinteät aineet voivat luokitella maailmanlaajuisesti kahteen tyyppiin: amorfinen tai kiteinen. Ja näiden kahden luokituksen välillä niiden alotrooppit jakautuvat.
Amorfinen hiili on yksinkertaisesti se, joka esittelee mielivaltaisen tetraedran, kuusikulmion tai linjojen seoksen, joka ei pysty luomaan rakenteellista mallia; Näin on hiilen, vihannesten tai aktivoitu hiilen, koksi, noki jne.
Kiteinen hiili koostuu rakenteellisista kuvioista, jotka muodostuvat minkä tahansa nostettujen geometrioiden; Esimerkiksi Diamond (kolmen dimensioinen tetraedraverkko) ja grafiitti (pinottu kuusikulmaiset arkit).
Voi palvella sinua: natriumnitraatti (nano3): rakenne, ominaisuudet, käytöt, riskitMissä on hiili?
Kaikissa elämänmuodoissa yleinen kemiallinen elementti on luonteeltaan yleinen, kolmessa kiteisessä muodossa: timantti, grafiitti ja opas.
Siellä on myös useita amorfisia hiilimineraalimuotoja (antrasiitti, ruskea, tyhmä, turve), nestemäiset muodot (öljylajit) ja sooda (maakaasu).
Sovellukset
Jälleen, kuten ominaisuudet ja rakenne, käyttö tai sovellukset ovat yhdenmukaisia hiilen alotrogos- tai mineralogisten muotojen kanssa. Joidenkin tunnettujen pisteiden lisäksi voidaan mainita tiettyjä yleisyyksiä. Tällaisia ovat:
-Hiiltä on käytetty pitkään mineraalien pelkistävänä aineena puhtaiden metallien saamiseksi; Esimerkiksi rauta, pii ja fosfori, muun muassa.
-Se on elämän kulmakivi, ja orgaaninen kemia ja biokemia ovat tämän heijastuksen tutkimuksia.
-Se on myös ollut fossiilinen polttoaine, jonka avulla ensimmäiset koneet voivat mennä hammaspyörilleen. Samoin häneltä saatiin hiilikaasu vanhoille valaistusjärjestelmille. Hiili oli synonyymi valolle, lämmölle ja energialle.
-Sekoitettuna lisäaineena raudan kanssa erilaisissa mittasuhteissa mahdollistivat terästen keksinnön ja parantamisen.
-Sen musta väri tapahtui taiteessa, erityisesti grafiitissa ja kaikki heidän iskuillaan tehdyt kirjoitukset.
Riskit ja varotoimet
Hiili ja sen kiinteät aineet eivät edusta mitään terveysriskiä. Joka on huolissaan hiilipuskista? He myyvät ne erälle joidenkin markkinoiden salien sisällä, ja niin kauan kuin ei ole lähellä tulta, heidän mustat lohkot eivät polta.
Koksi puolestaan voi edustaa riskiä, jos sen rikkipitoisuus on korkea. Kun palaminen vapauttaa rikki kaasuja, jotka myrkyllisen lisäksi edistävät happoa sadetta. Ja vaikka yhteistyö2 Pieninä määrinä se ei voi tukahduttaa meitä, se vaikuttaa valtavasti ympäristöön kasvihuonekaasuna.
Tästä näkökulmasta hiili on "pitkäaikainen" vaara, koska sen palaminen muuttaa planeettamme ilmastoa.
Ja fyysisemmässä mielessä kiintoaine tai hiilipitoiset materiaalit, jos ne ruiskutetaan, kuljetetaan helposti ilmavirroilla; Ja näin ollen ne otetaan käyttöön suoraan keuhkoihin, mikä voi vahingoittaa niitä perimyttämättä.
Muista on hyvin yleistä kuluttaa ”hiiltä”, kun jotkut ruoat ruokaavat.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.

