Magnesiumfosfaatti (MG3 (PO4) 2)
- 1628
- 435
- Edgar VonRueden
 Magnesiumfosfaatin rakenne ja kaava
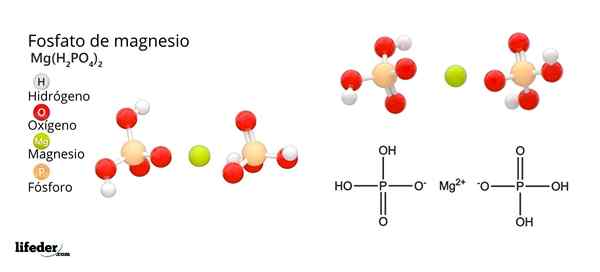
Magnesiumfosfaatin rakenne ja kaava Mikä on magnesiumfosfaatti?
Hän Magnesiumfosfaatti Se on termi, jota käytetään viittaamaan epäorgaanisten yhdisteiden perheeseen, jonka muodostaa magnesium, alkalinen metalli ja fosfaattia. Yksinkertaisimmalla magnesiumfosfaatilla on mg kemiallinen kaava3(PO4-A2. Kaava osoittaa, että jokaisesta kahdesta anionista PO43- Katiot on kolme2+ vuorovaikutuksessa näiden kanssa.
Näitä yhdisteitä voidaan myös kuvata magnesiumsuoloiksi, jotka ovat peräisin ortofosfahiinihaposta (H3Poikki4-A. Toisin sanoen magnesium "kerätään" fosfaatti -anionien väliin riippumatta sen epäorgaanisesta tai orgaanisesta esityksestä (MGO, MG (ei3-A2, Mgcl2, Mg (OH)2, jne.-A.
Näistä syistä johtuen magnesiumfosfaatit löytyvät useina mineraaleina. Jotkut näistä ovat: catteite -mg3(PO4-A2 · 22H2O-, struvita -(NH4) Mgpo4· 6H2Tai, joiden mikrokiteet ovat edustettuna ylemmässä kuvassa, holtedalita -mg2(PO4) (OH) - ja bobierrite -mg3(PO4-A2· 8H2JOMPIKUMPI-.
Bobierriitin tapauksessa sen kiteinen rakenne on monokliininen, kiteisillä aggregaateilla massiivisilla tuulettimilla ja ruusukoilla. Magnesiumfosfaateille on kuitenkin ominaista rikas rakenteellinen kemikaali, mikä tarkoittaa, että niiden ionit omaksuvat monia kiteisiä järjestelyjä.
Magnesiumfosfaattimuodot ja niiden kuormituksen neutraali
Magnesiumfosfaatit johtuvat H -protonien korvaamisesta3Poikki4. Kun ortofosforihappo menettää protonin, se pysyy kuin fosfaatti -dihydrogeenioni2Poikki4-.
Kuinka negatiivisen kuormituksen neutraloida magnesiumsuolan aiheuttamiseksi? Kyllä mg2+ Tilaa kaksi positiivista maksua, tarvitsee sitten kaksi h2Poikki4-. Siten saadaan magnesium -diácido -fosfaatti, MG (H2Poikki4-A2.
Sitten, kun happo menettää kaksi protonia, vetyfosfaatti -ioni pysyy, HPO42-. Nyt kuinka neutraloida nämä kaksi negatiivista varausta? Kuin MG2+ Tarvitset vain kaksi negatiivista maksua neutraloimiseksi, vuorovaikutuksessa yhden HPO -ionin kanssa42-. Tällä tavoin saadaan magnesiumhappofosfaatti: MGHPO4.
Voi palvella sinua: Magnesiumoksidi: rakenne, ominaisuudet, nimikkeistö, käyttöLopuksi, kun kaikki protonit menetetään, fosfaatti -anioni jää43-. Tämä vaatii kolme mg: n kationia2+ ja toisesta fosfaatista koota kiteiseen kiinteään. Matemaattinen yhtälö 2 (-3) + 3 (+2) = 0 auttaa ymmärtämään näitä stoikiometrisiä mittasuhteita magnesiumin ja fosfaatin suhteen.
Näiden vuorovaikutusten seurauksena tuotetaan heimojen magnesiumfosfaatti: MG3(PO4-A2. Miksi heimo on? Koska hän pystyy hyväksymään kolme H: n vastaavaa+ H: n muodostamiseksi uudelleen3Poikki4-
Poikki43-(AC) + 3H+(Ac) h3Poikki4(AC)
Magnesiumfosfaatit muiden kationien kanssa
Negatiivisten maksujen kompensointi voidaan saavuttaa myös muiden positiivisten lajien osallistumisella.
Esimerkiksi PO: n neutraloimiseksi43-, K -ionit+, Naa+, RB+, Nh4+, jne., Ne voivat myös välittää, muodostaen yhdisteen (x) mgpo4. Jos x on yhtä suuri kuin NH4+, Vedetön struvite mineraali muodostuu (NH4) Mgpo4.
Antaa. Tämän ansiosta voidaan syntetisoida lukuisia magnesiumfosfaattikiteitä (na3RBMG7(PO4-A6, Esimerkiksi).
Rakenne

Ylivoimainen kuva kuvaa mg -ionien välisiä vuorovaikutuksia2+ ja Po43- jotka määrittelevät kiteisen rakenteen. Se on kuitenkin vain kuva, joka osoittaa pikemminkin fosfaattien tetraedrisen geometrian. Sitten kiteinen rakenne merkitsee fosfaatti- ja magnesiumpalloja tetraedraa.
MG: n tapauksessa3(PO4-A2 Vedetön ionit omaksuvat rhomboedrisen rakenteen, jossa Mg2+ on koordinoitu O: n kuuden atomin kanssa.
Yllä oleva on havainnollistettu alemmassa kuvassa, ja siniset pallot ovat kobolttia, vain muuttamalla niitä magnesiumin vihreiden pallojen suhteen:
Voi palvella sinua: ei -rautapeiliset seokset: rakenne, ominaisuudet, käytöt, esimerkit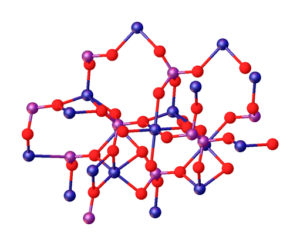
Aivan rakenteen keskellä Octaedro muodostaa kuuden punaisen pallon ympärillä olevan pallon ympärillä.
Lisäksi nämä kiteiset rakenteet kykenevät hyväksymään vesimolekyylit muodostaen magnesiumfosfaatti -hydraatit.
Tämä johtuu siitä, että ne muodostavat vety sillat fosfaatti-ioneilla (Hoh-o-po-33--A. Lisäksi jokainen fosfaatti -ioni pystyy hyväksymään jopa neljä vety sillaa; eli neljä vesimolekyyliä.
Kuin MG3(PO4-A2 Siinä on kaksi fosfaattia, se voi hyväksyä kahdeksan vesimolekyyliä (mikä tapahtuu bobierni -mineraalilla). Nämä vesimolekyylit puolestaan voivat muodostaa vety silloja muiden kanssa tai olla vuorovaikutuksessa positiivisten MG -keskuksien kanssa2+.
Ominaisuudet
Se on valkoinen kiinteä, muodostaen kiteiset rhombiset levyt. Sillä ei myöskään ole hajua ja makua.
Se on erittäin liukenematon veteen, vaikka se olisi kuuma, sen suuren kiteisen verkon energian vuoksi; Tämä on Mg: n monipuolisten ionien voimakkaan sähköstaattisen vuorovaikutuksen tuote2+ ja Po43-.
Toisin sanoen, kun ionit ovat monipuolisia ja niiden ioniset radiot eivät vaihtele kooltaan paljon, kiinteä aine osoittaa resistenssin sen liukenemiselle.
Sulaa arvoon 1184 ºC, mikä osoittaa myös voimakkaita sähköstaattisia vuorovaikutuksia. Nämä ominaisuudet vaihtelevat riippuen siitä, kuinka monta absorboiveden molekyyliä ja jos fosfaatti on joissakin sen protonoiduissa muodoissa (HPO42- tai h2Poikki4--A.
Käyttää/sovelluksia
Laksatiivinen
Sitä on käytetty laksatiivina ummetus- ja mahahappahappotiloille. Sen haitalliset sivuvaikutukset - ripulin ja oksentelun syntymisen vuoksi - ovat kuitenkin rajoittaneet niiden käyttöä. Lisäksi se todennäköisesti aiheuttaa maha -suolikanavan vaurioita.
Voi palvella sinua: molekyylihappi: rakenne, ominaisuudet, käytötLuunkorjaus
Magnesiumfosfaatin käyttöä luukudoksen korjaamisessa tutkitaan parhaillaan tutkittaessa MG: n levitystä (H2Poikki4-A2 sementinä.
Tämä magnesiumfosfaatin muoto täyttää tämän vaatimukset: se on biohajoava ja histoyhteensopiva. Lisäksi sen käyttöä luuhikudoksen uudistamisessa suositellaan sen vastus- ja nopeaan asetukseen.
Ortopedian materiaali
Amorfisen magnesiumfosfaatin (AMP) käyttöä arvioidaan biohajoavana ja ei -eksotermisenä ortopedisena sementinä. Tämän sementin tuottamiseksi sekoitetaan AMP -jauhe polyvinyylialkoholin kanssa kitin muodostamiseksi.
Elävissä olennoissa
Magnesiumfosfaatin päätehtävä on toimia MG -osana eläviä olentoja. Tämä elementti puuttuu lukuisiin entsymaattisiin reaktioihin, kuten katalysaattori tai välittäjä, joka on välttämätöntä elämälle.
Ihmisten MG -puute liittyy seuraaviin vaikutuksiin: CA -tasojen väheneminen, sydämen vajaatoiminta, NA: n pidättäminen, vähentyneet K -tasot, rytmihäiriöt, kestävät lihasten supistukset, oksentelu, pahoinvointi, lisäkilpirauhasen hormoni- ja vatsan ja kuukautiskrampien alhaiset verenkierron taso muiden joukossa.
Viitteet
- Mineraalitietojen julkaisu. (2001-2005). Bonierriitti. Palautettu HandbookOfmineralogy.org
- Sahar Mousa. (2010). Tutkimus magnesiumfosfaattimateriaalien synteesistä. Fosforitutkimustiedote Vol. 24, s. 16-21.
- Wikipedia. (2018). Magnesiumfosfaatti -heimojen. Haettu jstk.Wikipedia.org
- Pubchem. (2018). Magnesiumfosfaatti vedetön. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus
- Barbie, E., Lin, b., Goel, v.K -k -. Ja Bhaduri, S. (2016) Amorfisen magnesiumfosfaatti (AMP) -pohjaisen ei-eksotermisen ortopedisen sementin arviointi. Lääketieteellinen matto. Osa 11 (5): 055010.
- Yu, ja., Yu, ch. Ja dai, h. (2016). Kaavavan magnesiumluukementin valmistus. Regeneratiiviset biomateriaalit. Osa 4 (1): 231

