Galvaaniset soluosat, miten toimii, sovellukset, esimerkit

- 4113
- 403
- Juan Breitenberg V
Se Galvaaninen solu o Voltaic -kenno on eräänlainen sähkökemiallinen solu, joka koostuu kahdesta erilaisesta metallista, jotka on upotettu kahteen puoliksi -ltaan, jossa aktiivisessa liuoksessa oleva yhdiste on spontaani reaktio.
Sitten yksi metallista yhden puoliarvon kanssa hapettuu, kun taas toisen puolijalosmedian metalli vähenee, mikä tuottaa elektronien vaihtoa ulkoisen piirin läpi. Tämän avulla voidaan hyödyntää sähkövirtaa.
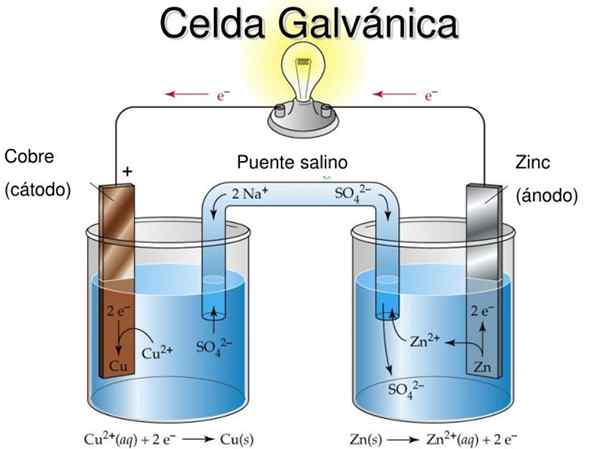
 Kuvio 1. Galvaanisen solun kaavio ja osat. Lähde: Korintti.PUCP.Edu.PE -PE.
Kuvio 1. Galvaanisen solun kaavio ja osat. Lähde: Korintti.PUCP.Edu.PE -PE. "Galvaanisen solun" nimi on yksi sähköisen kokeilun pioneerien kunniaksi: italialainen lääkäri ja fysiologi Luigi Galvani (1737-1798).
Galvani havaitsi vuonna 1780, että jos ne liittyivät eri metallien yhden pääkaapeliin ja vapaat päät otettiin yhteyttä sammakon ANCA: hon (kuollut), niin supistuminen tapahtui.
Ensimmäinen sähkökemiakennon rakentaminen sähkön tuottamiseksi oli kuitenkin myös italialainen Alessandro Volta (1745-1827) vuonna 1800 ja siten Voltaic-solun vaihtoehtoinen nimi.
Galvaanisen solun osat
Galvaanisen solun osat on esitetty kuvassa 1 ja ovat seuraavat:
1.- Anodinen puolijalkka
2.- Anodiumielektrodi
3.- Anodinen ratkaisu
4.- Katodinen semi -media
5.- Katodinen elektrodi
6.- Katodinen ratkaisu
7.- Suolaliuos
8.- Metallinen kapellimestari
9.- Volttimittari
Toiminta
Selittääksemme galvaanisen solun toimintaa, luotamme alempaan:
 Kuva 2. Galvaanisen solun didaktinen malli. Lähde: Slideserve.com
Kuva 2. Galvaanisen solun didaktinen malli. Lähde: Slideserve.com Galvaanisen solun perustavanlaatuinen idea on, että hapettumisreaktion kärsimä metalli on fyysisesti erotettu vähentyneestä metallista siten, että elektronien vaihto tapahtuu ulkoisen johtimen kautta, joka mahdollistaa sähkövirran virtauksen hyödyntämisen kautta , Esimerkiksi polttimon tai LED: n sytyttämiseksi.
Vasemmalla puolivälissä olevassa puolivälissä olevassa kuviossa 2 sinulla on metallinen kupariteippi (Cu), joka on upotettu kuparisulfaattiliuokseen (CUS04), Kun oikeassa puoliksi linnassa on sinkkinauhaan (Zn) upotettu sinkkisulfaattiliuokseen (ZNSO4-A.
On huomattava, että jokaisessa puoliksi -mediassa kunkin metalli on läsnä kahdessa hapettumistilassa: neutraalit metalliatomit ja saman metallin suolan metalli -ionit liuoksessa.
Jos metallinauhoja ei ole kytketty ulkopuolisella johtavalla kaapelilla, niin molemmat metallit hapettuu erikseen vastaaviin soluihinsa.
Kuitenkin, kun se on sähköisesti kytketty, hapettuminen tapahtuu Zn: ssä, kun taas CU: n vähentämisreaktio. Tämä johtuu siitä, että sinkin hapettumisaste on suurempi kuin kuparin.
Metalli, joka hapettaa, tuottaa metallia, joka vähenee ulkoreunan kautta ja tätä virran virtausta voidaan käyttää.
Voi palvella sinua: halogenoidut johdannaisetHapetus- ja pelkistysreaktiot
Reaktio, joka tapahtuu sinkkimetallielektrodin ja vesipitoisen sinkkisulfaattiliuoksen välillä, on seuraava:
Znjompikumpi(S) + Zn2+ (SW4-A2- → 2 Zn2+(AC) + (SW4-A2- + 2 e-
Sinkin (kiinteä) atomi anodisen elektrodin pinnalla oikean oikeanpuoleisessa, sinkin positiivisten ionien stimuloimana liuoksessa, tuottaa kaksi elektronia ja syntyy elektrodista, menemällä vesiliuokseen Positiivisena kaksois -ionina.
Tajusimme, että nettotulos oli, että neutraalin metallisi sinkin atomi, menettämällä kaksi elektronia, tuli sinkin ioni, joka lisää vesiliuokseen, niin että sinkkipalkki menetti atomin ja liuos sai positiivisen kaksinkertaisen ionin.
Vapautuneet elektronit mieluummin liikkuvat ulkoisen kaapelin läpi kohti toisen puolivälimedian metallia positiivisella kuormalla (Carto +). Sinkkibaari menettää massaa, koska sen atomit siirtyvät vähitellen vesiliuokseen.
Sinkin hapettuminen voidaan tiivistää seuraavasti:
Znjompikumpi(S) → Zn2+(AC) + 2 e-
Vasemmalla puolella esiintyvä reaktio on samanlainen, mutta vesiliuoksen kupari kaappaa kaksi elektronia (tulee toisesta puoliaiheisesta) ja talletetaan kuparin elektrodiin. Kun atomi vangitsee elektroneja, sen sanotaan vähenevän.
Kuparin vähentämisreaktio on kirjoitettu näin:
Cu2+(AC) + 2 e- → Cujompikumpi(S)
Kuparipalkki on taikina, koska liuoksen ionit kulkevat palkkiin.
Hapetus tapahtuu anodissa (negatiivinen), joka hylkää elektronit, kun taas vähennys tapahtuu katodissa (positiivinen), joka houkuttelee elektroneja. Elektroninvaihto tapahtuu ulkoisen ohjaimen kautta.
Suolaliuossilta
Suolaliuossilta tasapainottaa kuormat, jotka kerääntyvät kahteen puoliksi. Anodisessa puoliksi -diad -positiivisessa ionissa kerääntyy, kun taas katodissa on ylimääräinen negatiiviset sulfaatti -ionit.
Suolaliuossillan kannalta käytetään suolaa (kuten natriumkloridia tai kaliumkloridia) liuosta, joka ei puutu reaktioon, joka on käänteisessä U -muotoisessa putkessa, jonka päät on kytketty huokoisen materiaalin seinämään.
Suolaliuossillan ainoa tarkoitus on, että ionit suodatetaan jokaiseen solun tasapainottamiseen tai ylimääräisen kuormituksen neutralointiin. Siten suolaliuossillan läpi on virran virtaus suolaliuos -ionien läpi, joka sulkee sähköpiirin.
Hapetus- ja pelkistyspotentiaalit
Tavanomaiset hapettumis- ja pelkistyspotentiaalit ymmärretään.
Se voi palvella sinua: Scandio: historia, ominaisuudet, reaktiot, riskit ja käyttötarkoituksetSinkille sen vakiohapetuspotentiaali onhärkä = +0,76 V. Samaan aikaan kuparin vakiovähennyspotentiaali on jaruudukko = +0,34 V. Tämän galvaanisen solun tuottama elektromotiivivoima (FEM) on: FEM = +0,76 V + 0,34 V = 1,1 V.
Galvaanisen solun globaali reaktio voidaan kirjoittaa näin:
Znjompikumpi(S) + Cu2+(AC) → Zn2+(AC) + Cujompikumpi(S)
Sulfaatin ottaminen huomioon nettoreaktio on:
Znjompikumpi(S) + Cu2+ (SW4-A2- 25ºC → Zn2+ (SW4-A2-+ Cujompikumpi(S)
Sulfaatti on katsoja, kun taas metallit vaihtavat elektroneja.
Galvaanisen solun symbolinen esitys
Kuvion 2 galvaaninen solu on symbolisesti esitetty seuraavasti:
Znjompikumpi(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | cujompikumpi(S)
Yleissopimuksen mukaan vasemmalla puolella metalli hapettaa ja muodostaa anodin (-) ja erottaa palkki (|) sen ioni vesipitoiseen tilaan on aina sijoitettu. Anodinen puolivälimedium on erotettu katodista kahdella palkilla (||), jotka edustavat suolaliuosta siltaa. Oikealla puolella oleva metalli -semi -medium, joka on vähentynyt ja muodostaa katodin (+).
Galvaanisen solun symbolisessa esityksessä pää on aina metalli, joka hapettuu ja lopussa metalli asetetaan (kiinteässä tilassa), joka vähenee. On huomattava, että kuviossa 2 puolipiste on päinvastainen tavanomaisen symbolisen esityksen suhteen.
Sovellukset
Erilaisten metallien tavanomaiset hapettumispotentiaalit On mahdollista määrittää elektromotiivivoima, joka tuottaa näillä metalleilla rakennetun galvaanisen paalun.
Tässä osassa edellä mainittua sovelletaan edellisissä osissa muiden metallien kanssa rakennetun solun netto -elektromotorisen voiman laskemiseksi.
Esimerkkinä sovelluksesta tarkastellaan galvaanista rautasolua (usko) ja kuparia (Cu). Tietoina annetaan seuraavat pelkistysreaktiot ja sen standardin vähentämispotentiaali, ts. 25ºC: n ja 1M: n pitoisuus:
Usko2+(AC) + 2 e- → Usko(S). E1ruudukko = -0,44 V
Cu2+(AC) + 2 e- → Cu(S). E2ruudukko = +0,34 V
Seuraavan galvaanisen solun tuottama nettoelektromotorinen voima pyydetään:
Usko(S)| Usko2+(AC)(1m) || cu2+(AC)| Cu(S)
Tässä kasassa rauta hapettaa ja on galvaanisen solun anodi, kun kuparia vähenee ja on katodi. Raudan hapettumispotentiaali on sama, mutta vastakohtana sen pelkistyspotentiaaliin, toisin sanoen E1Oksa = +0,44.
Tämän galvaanisen solun tuottaman sähkömoottorin saamiseksi lisäämme raudan hapettumispotentiaalin kuparin pelkistyspotentiaalilla:
Voi palvella sinua: typpioksidit (NOX)FEM = E1Oksa + E2ruudukko = -E1ruudukko + E2ruudukko = 0,44 V + 0,34 V = 0,78 V.
Galvaaninen solu jokapäiväisessä elämässä
Galvaaniset solut päivittäistä käyttöä varten ovat kaukana muodosta, jota käytetään didaktisena mallina, mutta niiden toimintaperiaate on sama.
Yleisin käyttökenno on 1,5 V: n alkalinen akku sen eri esityksissä. Etunimi tulee, koska se on sarja soluja, jotka on kytketty sarjaan FEM: n lisäämiseksi.
Ladattavat litiumparistot perustuvat myös samaan galvaanisten solujen toimintaperiaatteeseen ja ovat niitä, joita käytetään älypuhelimissa, kelloilla ja muilla laitteilla.
Samoin autojen, moottoripyörien ja veneiden lyijyakut ovat 12 V ja perustuvat samaan galvaanisen solun toimintaperiaatteeseen.
Galvaanisia soluja käytetään estetiikassa ja lihaksen uudistamisessa. On kasvohoitoja, jotka koostuvat virran levittämisestä kahdella elektrodilla rullan tai pallon muodossa, jotka puhdistavat ja säilittävät ihoa.
Nykyisiä pulsseja sovelletaan myös lihaksien uudistamiseen ihmisillä, jotka ovat uupumustilassa.
Kotitekoisen galvaanisen solun rakentaminen
Kotitekoisen galvaanisen solun rakentamiseen on monia tapoja. Yksi yksinkertaisimmista on etikan käyttäminen liuoksena, teräskynnet ja kuparikaapelit.
Materiaalit
-Kertakäyttöiset muoviset astiat
-valkoviinietikka
-Kaksi teräsruuvia
-Kaksi paljaa paljaa kuparilankaa (eristämättä tai lakkaa)
-Volttimittari
Menettely
-Täytä ¾ lasin osa etikalla.
-Liity kahteen teräsruuviin useilla kierroksilla lanka, jättäen langan pala ilman käämiä.
Kuparikaapelin loputon pää on taitettu käänteiseen U -muotoiseen.
 Kuva 3. Kotitekoinen galvaaninen solu ja yleismittari. Lähde: YouTube.com
Kuva 3. Kotitekoinen galvaaninen solu ja yleismittari. Lähde: YouTube.com Toinen kuparikaapelin pala on taitettu myös käänteiseen ja roikkuu lasin reunassa halkaisijaltaan vastakkaisella asennolla kuin upotettuja ruuveja, niin että kuparin yksi osa on etikan sisällä ja toinen kuparikaapelin osa ulkopuolella lasi.
Voltimetimittaisten kaapelien vapaat päät on kytketty tämän yksinkertaisen solun tuottaman sähkömoottorin mittaamiseksi. Tämän tyyppisen solun fem on 0,5 V. Alkalisen akun FEM: n vastaamiseksi on tarpeen rakentaa vielä kaksi solua ja liittää kolmeen sarjaan, niin että 1,5 V: n akku saadaan
Viitteet
- Borneo, r. Galvaaniset ja elektrolyyttiset solut. Haettu: quimica -luokat.Blogin.com
- Cedrón, J. Yleinen kemia. PUCP. Toipunut: Korintti.PUCP.Edu.PE -PE
- Farrera, l. Johdanto sähkökemiaan. Unam -fysikaalis -osasto. Palautettu: DEPA.Fquim.Yksinäinen.MX.
- Wikipedia. Sähkökemiallinen kenno. Palautettu: on.Wikipedia.com.
- Wikipedia. Galvaaninen solu. Palautettu: on.Wikipedia.com.

