Sähkökemialliset solut

- 712
- 59
- Alonzo Kirlin
Mitkä ovat sähkökemialliset solut?
Se sähkökemialliset solut Ne ovat laitteita, joissa kemialliset reaktiot kulkevat, missä kemiallinen energia muuttuu sähköksi tai päinvastoin. Nämä solut muodostavat sähkökemian sydämen, sielu on mahdollinen elektronien vaihto, joka voi tapahtua, spontaani tai ei spontaanisti, kahden kemiallisen lajin välillä.
Yksi kahdesta lajista hapettuu, menettää elektronit, kun taas toinen vähenee voittamalla luovutetut elektronit. Yleensä vähentynyt laji on metallinen kationi liuoksessa, joka saadaan sähköisesti saamaan sähköisesti samasta metallista valmistetulle elektrodille. Toisaalta hapettua lajia on metalli, tulossa metallikationeiksi.
 Danielin sähkökemiallinen kennokaavio. Lähde: rechua [cc by (https: // creativecommons.Org/lisenssit/by/3.0)]
Danielin sähkökemiallinen kennokaavio. Lähde: rechua [cc by (https: // creativecommons.Org/lisenssit/by/3.0)] Esimerkiksi ylivoimainen kuva edustaa Danielin solua: yksinkertaisin kaikista sähkökemiallisista soluista. Metallinen sinkkielektrodi hapetetaan, vapauttaen Zn -kationit2+ vesipitoiseen ympäristöön. Tämä tapahtuu ZnSO -säiliössä4 vasemmalta.
Oikealla, CuO: n sisältävä liuos4 Se on vähentynyt, muuttaen kationien cu2+ Metallisessa kuparissa, joka on talletettu kuparin elektrodiin. Tämän reaktion kehittymisen aikana elektronit kulkevat ulkoisen piirin, joka aktivoi niiden mekanismeja; Ja siksi laitteen toiminnan tarjoaminen sähkö.
Sähkökemialliset solukomponentit
Elektrodit
Sähkökemiallisissa soluissa syntyy tai kulutetaan. Elektronien asianmukaisen virtauksen varmistamiseksi on oltava materiaaleja, jotka ovat hyviä sähköjohtimia. Täältä tulevat elektrodit ja ulkoinen piiri, joka varustetaan kuparin johdotuksella, hopealla tai kultalla.
Elektrodit ovat materiaaleja, jotka tarjoavat pinnan, jossa kehitetään sähkökemiallisten solujen reaktioita. Niissä esiintyy kahta tyyppiä:
- Anodi, elektrodi, jossa hapetus tapahtuu.
- Katodi, elektrodi, jossa vähennys tapahtuu.
Elektrodit voivat olla valmistettu reagoivasta materiaalista, kuten Danielin solun (sinkki ja kupari) tapauksessa; tai inertistä materiaalista, kuten ne on valmistettu platinasta tai grafiitista.
Anodin määrittämät elektronit on päästävä katodiin; Mutta ei liuoksen kautta, vaan matkalla metallikaapeli, joka yhdistää molemmat elektrodit ulkoiseen piiriin.
Elektrolyytin liukeneminen
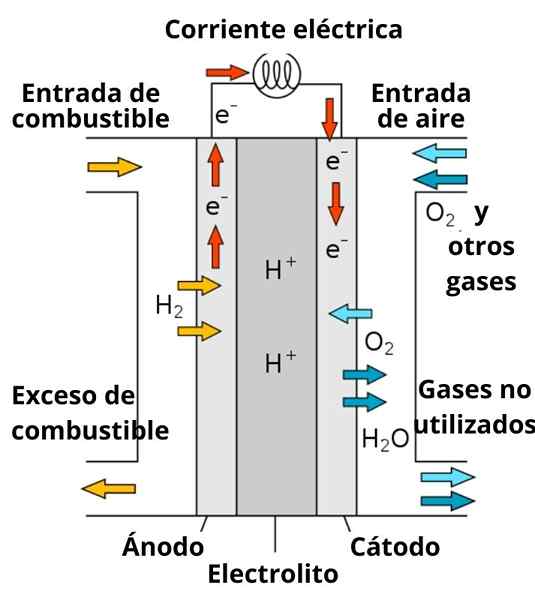 Protonien kaavio johtavaa polttoakkuakkua
Protonien kaavio johtavaa polttoakkuakkua Elektrodit ympäröivällä liukenemisella on myös tärkeä rooli, koska se on rikastettu vahvoilla elektrolyytteillä; kuten: kcl, kno3, NaCl, jne. Nämä ionit suosivat jossain määrin elektronien kulkeutumista anodista katodiin, samoin kuin niiden johtamisen elektrodien läheisyydessä vuorovaikutuksessa lajien kanssa vähentääkseen.
Esimerkiksi merivesi johtaa paljon parempaa sähköä kuin tislattua vettä, jolla on alhaisempi ionipitoisuus. Siksi sähkökemiallisilla soluilla on vahvoja elektrolyyttejä niiden komponenttien keskuudessa.
Suolaliuos
Liuoksen ionit alkavat ympäröidä elektrodit aiheuttaen kuormituksen polarisaation. Katodin ympärillä oleva liukeneminen alkaa latautua negatiivisesti, koska kationien vähenee; Danielin solun tapauksessa cu -kationit2+ Tallettamalla metallisen kuparina katodiin. Siten positiiviset maksut ovat alijäämä.
Täällä suolaliuossilta puuttuu kuormitusten tasapainottamiseen ja estämään elektrodit polarisoitumaan. Suolaliuossillan katodekationien sivulle tai osastolle muuttuu joko k+ tai Zn2+, CU: n syrjäyttäminen2+ kulutettu. Sillä välin suolaliuosta siirtyy anioneihin ei3- Kohti anodiosastoa, neutraloida Zn -kationien kasvava pitoisuus2+.
Se voi palvella sinua: kaliumdikromaatti: kaava, ominaisuudet, riskit ja käytötSuolaliuos -silta koostuu tyydyttyneestä suolaliuoksesta, jonka päät peitetään läpäisevällä ionigeelillä, mutta vedenpitävä vesi.
Tyypit sähkökemialliset solut ja miten ne toimivat
Tapa, jolla sähkökemiallinen solu toimii, riippuu tyypistä, joka on. Kaksi tyyppiä on pohjimmiltaan kahta: galvaaninen (tai voltaatinen) ja elektrolyyttinen
Galvaanit
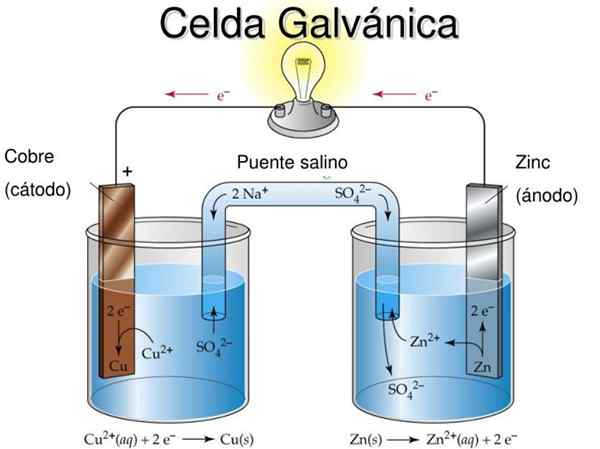
Danielin solu on esimerkki galvaanisesta sähkökemiakennosta. Niissä reaktiot tapahtuvat spontaanisti ja akun potentiaali on positiivinen; Mitä suurempi potentiaali, sitä suurempi sähkö, joka toimittaa solua.
Paristot tai paristot ovat tarkasti galvaanisia soluja: kahden elektrodin välinen kemiallinen potentiaali muuttuu sähköenergiaksi, kun ulkoinen piiri puuttuu, joka yhdistää ne. Siten elektronit siirtyvät anodista, valaisevat laitteet, joihin akku on kytketty, ja palautetaan suoraan katodiin.
Elektrolyyttinen
Elektrolyyttiset solut ovat niitä, joiden reaktioita ei tapahdu spontaanisti, ellei niitä toimittaa sähköenergialla ulkoisesta lähteestä. Tässä tapahtuu päinvastainen ilmiö: Sähkö antaa ei -spontaanien kemiallisten reaktioiden kehittymisen.
Yksi tunnetuimmista ja arvokkaista reaktioista, jotka tapahtuvat tämän tyyppisissä soluissa, on elektrolyysi.
Ladattavat akut ovat esimerkkejä elektrolyyttisistä ja samalla galvaanisia: ne ladataan kemiallisten reaktioidensa kääntämiseksi ja alkuperäisten olosuhteiden uudelleenkäytön palauttamiseksi uudelleen.
Esimerkit
Danielin solu
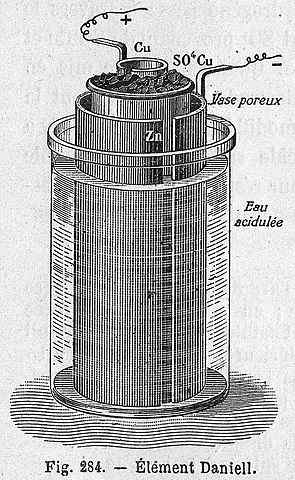 Danielin solujärjestelmä
Danielin solujärjestelmä Seuraava kemiallinen yhtälö vastaa Danielin solun reaktiota, johon sinkki ja kupari osallistuvat:
Voi palvella sinua: vuokraa halogeenuros: ominaisuudet, hankkiminen, esimerkkejäZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Mutta cu -kationit2+ ja Zn2+ Ne eivät ole yksin, vaan mukana niin anionit42-. Tämä solu voidaan edustaa seuraavasti:
Zn | Znso4 Ja Ja Cuso4 Ja Cu
Danielin solu voidaan rakentaa mihin tahansa laboratorioon, mikä toistuu hyvin käytännössä sähkökemian käyttöönotossa. Kuten cu2+ Se talletetaan Cu: ksi, CUSO -liuoksen sininen väri4 Se katoaa.
Platina- ja vetykenno
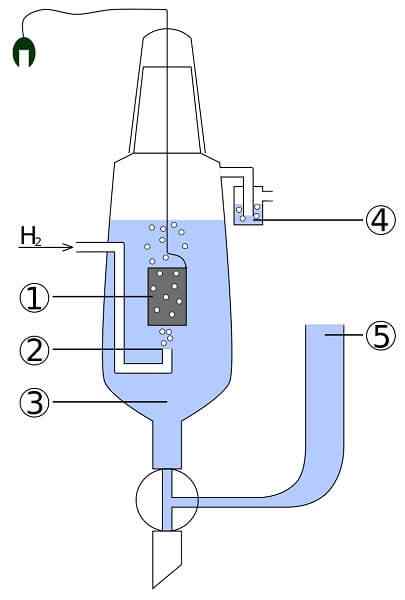 Platinum- ja vetykennon kaavio: 1. 2 platinaelektrodi. Vetykaasu 3. Happoliuos 4. Hidroseal 5. Unionin talletus
Platinum- ja vetykennon kaavio: 1. 2 platinaelektrodi. Vetykaasu 3. Happoliuos 4. Hidroseal 5. Unionin talletus Kuvittele solu, joka kuluttaa kaasumaista vetyä, tuottaa metallihopeaa ja samalla se vie sähköä. Tämä on platina- ja vetykenno, ja sen yleinen reaktio on seuraava:
2AGCL (S) + H2(g) → 2Ag (s) + 2H+ + 2CL-
Täällä anodilokerossa meillä on inertti platinaelektrodi, upotettu veteen ja johon kaasusvety pumpataan. H2 hapeteta h+ ja tuottaa elektronit AGCL: n maitomaiseen saostumaan katodilokerossa metallisella hopeaelektrodilla. AGCL vähenee tässä hopeassa ja elektrodi taikina kasvaa.
Tämä solu voidaan edustaa seuraavasti:
Pt, h2 Ja H+ Ja Ja Cl-, AgCl | Ag
Downs -solu
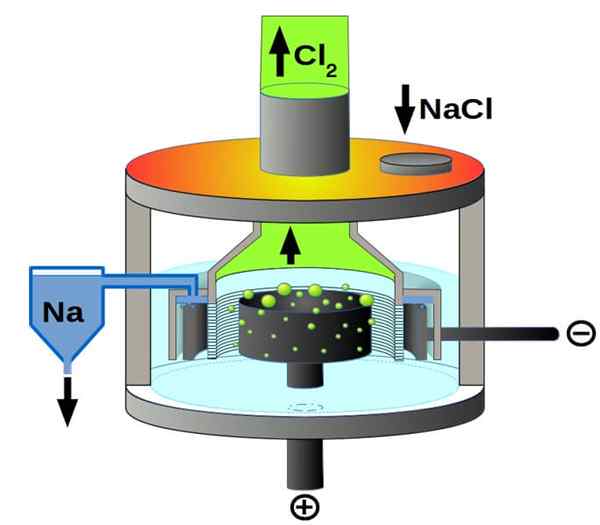 Natriumkloridielektrolyysin alamäki -solukaavio. Lähde: Pchemiker, CC BY-SA 4.0, Wikimedia Commons
Natriumkloridielektrolyysin alamäki -solukaavio. Lähde: Pchemiker, CC BY-SA 4.0, Wikimedia Commons Ja lopuksi, elektrolyyttisten solujen joukossa meillä on sulaa natriumkloridia, joka tunnetaan paremmin nimellä Downs Cell. Täällä sähköä tehdään kulkemaan elektrodien läpi sulan NaCl -määrän, ja siten niistä on peräisin seuraavista reaktioista:
Toinen+(l) + 2e- → 2NA (s) (katodi)
2CL-(L) → Cl2(g) + 2e- (anodi)
2nacl (l) → 2na (s) + cl2g) (globaali reaktio)
Siksi voidaan valmistaa sähkö- ja natriumkloridin, metallisen natrium- ja kloorikaasun ansiosta.

