Natriumsyanidi (NACN) rakenne, ominaisuudet, riskit, käytöt

- 4784
- 330
- Shawn Stanton II
Hän Natriumsyanidi Se on epäorgaaninen suola, jonka muodostuu natriumkationista+ ja syanidianionin CN-. Sen kemiallinen kaava on NACN. Se tunnetaan myös nimellä natriumsyanidi, se on valkoinen kiteinen kiinteä aine. Se on hygroskooppinen, toisin sanoen se imee vettä ympäristöstä, ja sen kiteet ovat kuutiometriä, kuten natriumkloridi NaCl.
Veteen liukenemisen yhteydessä sillä on taipumus muodostaa HCN -vety syanidi. Hänen ratkaisunsa liukenevat kultaa ja hopeaa helposti. Tämä ominaisuus tekee sen käytöstä kullan ja hopean purkamiseen mineraaleistaan. Tätä tarkoitusta varten käytettyjä ratkaisuja kierrätetään, ts. Niitä käytetään uudelleen useita kertoja.
 Natrium natrium natriumsyanidi. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Natrium natrium natriumsyanidi. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Jotkut syanidi onnistuu kuitenkin pakenemaan tiettyjä jätealueita, mikä edustaa vaaraa eläimistölle ja ihmiselle, koska syanidi on erittäin myrkyllinen ja voi aiheuttaa kuoleman.
NACN: ää käytetään kemianteollisuudessa välittäjänä monentyyppisten yhdisteiden, kuten väriaineiden, kemikaalien valmistamiseksi maatalouden ja lääkkeiden tai lääkkeiden kemikaalit.
Natriumsyanidi on erittäin vaarallinen yhdiste, koska se voi aiheuttaa kuolemaa, joten sitä on manipuloitava äärimmäisen varoen.
[TOC]
Rakenne
Natriumsyanidi muodostuu ionin Na+: n ja ionin CN: n avulla-.
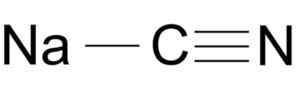 Natriumsyanidimolekyylin rakenne NACN. Arrowsmaster [julkinen alue], lähde: Wikimedia Commons.
Natriumsyanidimolekyylin rakenne NACN. Arrowsmaster [julkinen alue], lähde: Wikimedia Commons. Syanidi -ionissa on auto -auto ja yksi typen N: stä, jotka ovat yhdistäneet toisiaan kolminkertaisella linkillä.
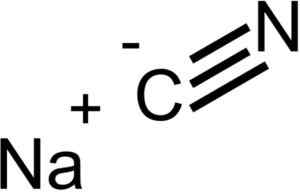 Ionit, jotka muodostavat natriumsyanidi NACN. EPOP [julkinen alue]. Lähde: Wikimedia Commons.
Ionit, jotka muodostavat natriumsyanidi NACN. EPOP [julkinen alue]. Lähde: Wikimedia Commons. NACN: llä on sama kiteinen rakenne kuin NaCl, joten sen kiteet ovat kuutiometriä.
Nimikkeistö
-Natriumsyanidi
-Natriumsyanidi
Ominaisuudet
Fyysinen tila
Hygroskooppinen valkoinen kiteinen kiinteä kiinteä (absorboi vettä ympäristöstä).
Molekyylipaino
49 007 g/mol
Sulamispiste
563,7 ºC
Kiehumispiste
1496 ºC
Leimahduspiste
Se ei ole syttyvä. Mutta jos se altistuu tulipalolle, tapahtuu HCN -vety syanidi ja typpioksidit.
Voi palvella sinua: sublimointi: käsite, prosessi ja esimerkitTiheys
1 595 g/cm3 20 ºC
Liukoisuus
Hyvin liukoinen veteen: 48 g/100 ml 10 ° C: ssa, 82 g/100 ml 35 ° C: ssa. Liukenee hieman alkoholiin
Dissosiaatiovakio
Se hydrolysoidaan vesiliuoksessa, joka tuottaa HCN -vety syanidia. Tämän hydrolyysin vakio on kh = 2,5 x 10-5.
PHE
NACN -vesiliuokset ovat voimakkaasti emäksisiä
Kemialliset ominaisuudet
Kun se liukenee veteen, se erottuu NA -ioneissaan+ ja CN-. Vesiliuoksessa syanidi -ioni CN- Ottaa protoni h+ Vesi H2Tai muodostaen HCN: n ja OH -ionin-, Joten liuoksesta tulee emäksistä.
CN- + H2O → HCN + OH-
Tästä syystä heidän vesiliuokset hajoavat nopeasti säilyttämällä, muodostaen HCN -vetysyanidin.
Se on syövyttävää alumiinia kohtaan. Sen liuokset liuottavat helposti AU: n ja hopean AG: n ilmassa.
Se on kelatoiva aine, koska syanidianioni CN- Se voi helposti liittyä muihin metalleihin, kuten hopea, kulta, elohopea, sinkki, kadmium jne.
Esittelee katkeran mantelin heikon hajun.
Riskejä
On käsiteltävä erittäin huolellisesti. Se on erittäin myrkyllinen yhdiste, estää tärkeitä aineenvaihduntaprosesseja ja johtaa kuolemaan sekä nielemisen, hengityksen, ihon imeytymisen tai silmäkontaktin suhteen.
Jos NACN hengitetään, se liukenee hengitysteiden limakalvoon ja kulkee verenkiertoon. NACN: n syanidi -ionilla on voimakas affiniteetti raudaan +3: n hapettumistilassa, ts. Ferrikationi uskossa3+.
Kun syanidi imeytyy, se reagoi nopeasti uskon kanssa3+ Solujen mitokondrioiden tärkeästä entsyymi (oksidaasisytokromi), estäen tiettyjen hengitysprosessien suorittamisen.
Siksi solujen hengitys on estetty tai jarrutus ja sytotoksinen hypoksia. Se tarkoittaa, että solut ja kudokset eivät pysty käyttämään happea, etenkin aivo- ja sydänsoluja.
Tällä tavoin tapahtuu pysyviä tai tappavia vaurioita. Tämä voi tapahtua sekä ihmisissä että eläimissä.
Jos verisuonten ruuhka ja mahalaukun limakalvojen korroosio nauttii, sen lisäksi, mitä on jo mainittu.
Voi palvella sinua: Justus von Liebig Natriumsyanidi NACN voi aiheuttaa kuoleman. Kirjailija: Openicons. Lähde: Pixabay.
Natriumsyanidi NACN voi aiheuttaa kuoleman. Kirjailija: Openicons. Lähde: Pixabay. Se ei ole polttoainetta, mutta kosketuksessa happojen kanssa se vapauttaa HCN: n, joka on erittäin syttyvä ja myrkyllinen.
Jos se sulaa nitriittien tai kloorien kanssa, se voi hyödyntää.
Saada
Se voidaan saada natrium -na, ammoniakki nh3 ja hiili c. Natrium reagoi ammoniakin kanssa, joka antaa natrium -nanhia2-
2 Na + 2 NH3 → 2 Nanh2 + H2↑
Natriumamidia kuumennetaan hiilellä 600 ºC: n nopeudella ja tuottaa natriumsyanamidi Na2NCN, josta sitten hiilellä 800 ° C: ssa tulee natriumsyanidi:
2 Nanh2 + C → 2 h2↑ + NA2Ncn
Naa2NCN + C → 2 NACN
Toinen menetelmä on sulattaa kalsium- ja hiilisyanamidi C natriumkarbonaatilla Na2Yhteistyö3-
Cancn + C + NA2Yhteistyö3 → Caco3 + 2 NACN
Se voidaan myös valmistaa ohittamalla typpikaasua n2 natriumkarbonaatin kuuma seos2Yhteistyö3 ja hiili jauhettu jauhettu, käyttämällä uskon uskoa katalyyttinä tai kiihdyttimenä reaktiosta:
Naa2Yhteistyö3 + 4 c + n2 → 2 NACN + 3 Co ↑
Sovellukset
Kulta- ja hopea -mineraalien uuttamisessa. Seuraukset
Natriumsyanidia on käytetty pitkään kultaa ja hopeametallien uuttamiseen sen mineraaleista.
Prosessissa käytetty syanidi kierrätetään, mutta jokin pakenee jätekalmusta yhdessä raskasmetallien kanssa.
Linnut, lepakot ja muut eläimet, jotka juovat näistä syanidilagoneista, on myrkytetty.
Romania -padosta on kirjaa, joka piti jätteiden lampia eristettynä ja vaurioitunut säätapahtuma.
Seurauksena on, että tonnia syanidia vapautettiin Sasar -joelle ja lähellä oleviin pohjavesikerroksiin, kuten Lapus, Somes, Tisza Rivers, päättyen Tonavaan.
Tämä aiheutti eläinkuolemien vesiputouksen tai toisin sanoen ekologisen katastrofin.
 Kultapoisto syanidilla Uudessa -Seelannissa noin vuonna 1918. Voit nähdä saastuneen veden määrän, joka purettiin läheisissä joissa. Kansalliskirjasto NZ Commonsissa [ei rajoituksia]. Lähde: Wikimedia Commons.
Kultapoisto syanidilla Uudessa -Seelannissa noin vuonna 1918. Voit nähdä saastuneen veden määrän, joka purettiin läheisissä joissa. Kansalliskirjasto NZ Commonsissa [ei rajoituksia]. Lähde: Wikimedia Commons. Muiden kemiallisten yhdisteiden tuotannossa
Natriumsyanidi NACN: tä käytetään erityyppisten orgaanisten yhdisteiden synteesissä.
Voi palvella sinua: natriumoksidi (NA2O): rakenne, kaava, ominaisuudet, riskitEsimerkiksi pigmentit ja väriaineet valmistetaan (mukaan lukien optiset kiillotukset), yhdisteet käytettäväksi maataloudessa tai maatalouden kemikaalissa ja erilaisia farmaseuttisia tuotteita.
Se myös hankkia metalli -ionien kelatoivia tai sieppausaineita.
Natriumsyanidilla valmistetaan nitriilejä, jotka on valmistettu, jotka on käsitelty happahapon tai alkalisen vesiliuoksen avulla karboksyylihappojen saamiseksi.
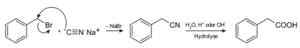 Karboksyylihapon valmistus natriumsyanidilla NACN. Roland Mattern [julkinen alue]. Lähde: Wikimedia Commons.
Karboksyylihapon valmistus natriumsyanidilla NACN. Roland Mattern [julkinen alue]. Lähde: Wikimedia Commons. Se mahdollistaa rasvahappojen valmistelun syaaniryhmillä, raskasmetallisyanideilla ja syanidi -vety HCN: llä.
Metalliteollisuudessa
NACN: tä käytetään galvanoplastian tai metallielektrodissa (metallipinnoite muiden kanssa) käytetyissä liuoksissa, esimerkiksi sinkki.
Se on kovettuneesta teräksestä. Se palvelee myös metallien puhdistuksessa.
Muissa käytöissä
Natriumsyanidi on välittäjä nylonin valmistuksessa.
Sitä käytetään mineraalien erottamiseen vaahtolla.
Sovellukset käytöstä, kyseenalaistettu tai erittäin harvinainen
Kansakuntaa käytettiin jyrsijöiden, kuten kanien ja rottien ja niiden urien, poistamiseen ja termiesten lopettamiseen pesiin.
Sitä käytetään tällä hetkellä toisinaan kojoottien, kettujen ja villikoirien poistamiseen. Sitä käytetään kapselien muodossa yksinkertaisina tai useana annoksena laiduntamismaissa, metsästyksessä ja metsissä.
Äärimmäisen myrkyllisyytensä vuoksi NACN: n on käytettävä vain valmistautuneita ihmisiä.
Tätä käyttöä pidetään erittäin vaarallisena ihmiselle, mutta on niitä, jotka edelleen käyttävät sitä.
 Villielämää ei pidä eliminoida, koska nämä eläimet taistelevat jo selviytyäkseen vaikeissa olosuhteissa. Kirjoittaja: Maxwdhs. Lähde: Pixabay.
Villielämää ei pidä eliminoida, koska nämä eläimet taistelevat jo selviytyäkseen vaikeissa olosuhteissa. Kirjoittaja: Maxwdhs. Lähde: Pixabay. Maataloudessa sitä aiemmin käytettiin sitrushedelmäpuiden ja muiden hedelmien haisemiseen. Sitä käytettiin myös hyönteismyrkkynä ja vähäisimyrkkinä (punkkien eliminaattori), jota levitettiin sadonkorjuun jälkeen, ei -luurakalnaattomissa sitrushedelmissä tai niiden kuljettamiseen käytettyjen kuorma -autojen kuristamiseen. Sitä käytettiin myös alusten, rautatievaunujen ja varastojen haisemiseen.
Natriumsyanidin korkea toksisuus on kyseenalaistanut kaikki nämä käytöt. Tästä syystä sitä ei enää käytetä tai vain hyvin harvoin ja hyvin hallituissa olosuhteissa.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Natriumsyanidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Hurst, h.JA. ja Martin, M.D -d. (2017). Toksikologia. Syanidi. Farmakologiassa ja hammaslääketieteen terapeuttissa (seitsemäs painos). ScienEdirect.com.
- Kopakka, r.W -. ja Dziwenka, M. (2015). Kemiallisen sodankäynnin agenttien uhkia villieläimille. Kemiallisten sodankäynnin agenttien toksikologian käsikirjassa (toinen painos). ScienEdirect.com.
- Morrison, r.T. ja Boyd, R.N. (2002). Orgaaninen kemia. 6. painos. Prentice-sali.
- « Rikkitrioksidi (SO3) rakenne, ominaisuudet, riskit, käyttää
- Bariumoksidi (BAO) rakenne, ominaisuudet, käytöt, riskit »

