Rikkitrioksidi (SO3) rakenne, ominaisuudet, riskit, käyttää
- 3709
- 658
- Alonzo Kirlin
Hän Rikkitrioksidi Se on epäorgaaninen yhdiste, joka muodostuu rikkiatomin (S) ja 3 happiatomien (O) liitoksella (O). Sen molekyyl kaava on niin3. Huoneenlämpötilassa, niin3 Se on neste, joka antaa kaasuja ilmassa.
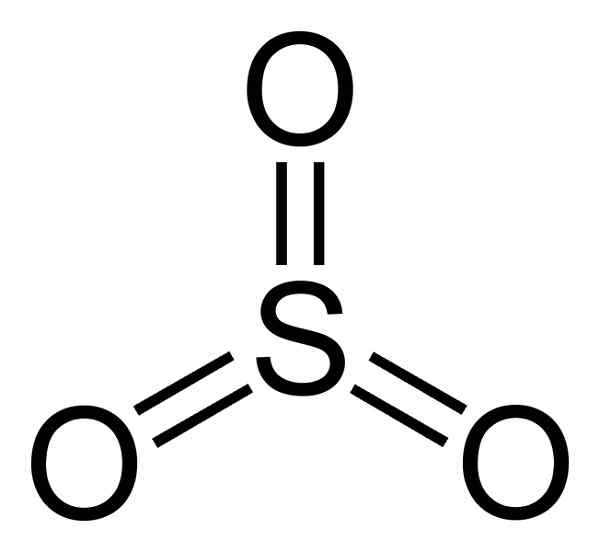
SO: n rakenne3 Kaasuma on litteä ja symmetrinen. Kolme happea sijaitsevat tasapuolisesti rikin ympärillä. Niin3 Reagoi väkivaltaisesti veden kanssa. Reaktio on eksoterminen, mikä tarkoittaa, että lämpöä tuotetaan, toisin sanoen paljon lämmitetään.
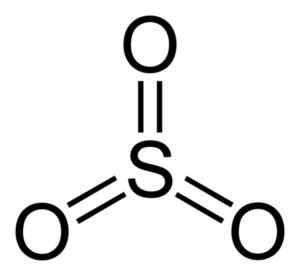 Rikkitrioksidimolekyyli niin3. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Rikkitrioksidimolekyyli niin3. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Kun niin3 Neste jäähtyy, siitä tulee kiinteä, jolla voi olla kolmen tyyppisiä rakenteita: alfa, beeta ja gamma. Vakain on alfa, kerrosten muodossa yhdessä toistensa kanssa, jotka muodostavat verkon.
Kaasumaista rikkitrioksidia käytetään tupakoinnin rikkihapon valmistamiseen. Toinen sen tärkeistä sovelluksista on orgaanisten yhdisteiden sulfonaatio, ts. Ryhmien lisääminen -niin3- näihin. Siten voidaan valmistaa hyödyllisiä kemikaaleja, kuten pesuaineita, väriaineita, torjunta -aineita, muun muassa.
Niin3 Se on erittäin vaarallinen, se voi aiheuttaa vakavia palovammoja, silmiä ja ihovaurioita. Sitä ei myöskään pidä hengittää tai nauti, koska se voi aiheuttaa kuoleman sisäisissä palovammoissa, suussa, ruokatorvessa, vatsassa jne.
Näistä syistä sitä on manipuloitava erittäin varovaisesti. Sinun ei pitäisi koskaan ottaa yhteyttä vettä tai palavia materiaaleja, kuten puu, paperi, kankaat jne., Tulipalo voidaan tuottaa. Sitä ei myöskään pidä hylätä tai viemäriä räjähdyksen vaaran vuoksi.
Niin3 Teollisuusprosesseissa syntyneitä kaasumaisia ei pitäisi vapauttaa ympäristöön, koska se on yksi niistä, jotka ovat vastuussa happosateesta, joka on jo vaurioitunut suuria metsien pidennyksiä maailmassa.
[TOC]
Rakenne
Rikkitrioksidimolekyyli niin3 Kaasumaisessa tilassa sillä on tasainen kolmion muotoinen rakenne.
Tämä tarkoittaa, että sekä rikki että kolme happea löytyvät samasta tasosta. Lisäksi hapen ja kaikkien elektronien jakautuminen on symmetrinen.
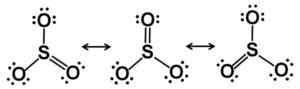 Lewis Resonance Starcutres. Elektronit jakautuvat tasapuolisesti SO: ssa3. Kirjoittaja: Marilú Stea.
Lewis Resonance Starcutres. Elektronit jakautuvat tasapuolisesti SO: ssa3. Kirjoittaja: Marilú Stea. Solid -state -tyyppisissä SO -rakenteissa tunnetaan3: Alfa (α-So3), beeta (β-So3) ja gamma (γ-So3-A.
Gamma muodostaa γ-niin3 Sisältää syklisiä trimmerkkejä, ts. Kolme niin3 yhdessä muodostaen syklisen tai renkaan muotoisen molekyylin.
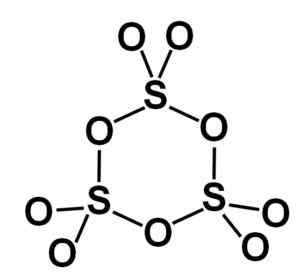 Kiinteän rikkitrioksidityyppisen gamman rengasmolekyyli. Kirjoittaja: Marilú Stea.
Kiinteän rikkitrioksidityyppisen gamman rengasmolekyyli. Kirjoittaja: Marilú Stea. Beeta β-So -vaihe3 Siinä on äärettömiä kierteisiä koostumuksen ketjuja4 yhdistyneet toistensa kanssa.
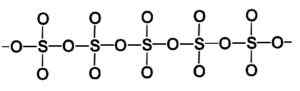 Kiinteän rikkitrioksidityyppisen beeta -rakenne. Kirjoittaja: Marilú Stea.
Kiinteän rikkitrioksidityyppisen beeta -rakenne. Kirjoittaja: Marilú Stea. Vakain tapa on alfa α-So3, Samanlainen kuin beeta, mutta kerrosrakenne, kun yhdistyneet ketjut muodostavat verkon.
Nimikkeistö
-Rikkitrioksidi
-Rikkihappoanhydridi
-Rikkioksidi
-Sw3 Gamma, γ-So3
-Sw3 beeta, β-niin3
-Sw3 Alfa, α-niin3
Fyysiset ominaisuudet
Fyysinen tila
Huoneenlämpötilassa (noin 25 ºC) ja ilmakehän paineessa, niin3 Se on väritön neste, joka emittoi höyryjä ilmassa.
Kun niin3 Neste on puhdasta 25 ºC: n kohdalla on seos niin3 monomeerinen (yksi molekyyli) ja trimeerinen (3 sidottu molekyyli) kaavan S3JOMPIKUMPI9, kutsutaan myös niin3 Gamma γ-So3.
Voi palvella sinua: Rankine -asteikko: Mikä on, tulokset, esimerkitLämpötilaa alentaessasi, jos niin3 Se on puhdasta, kun se saavuttaa 16,86 ºC, se jähmettyy tai jäätyy γ-So3, kutsutaan myös "niin jää3".
Jos se sisältää pieniä määriä kosteutta (jopa erittäin pieniä jälkiä tai määriä), niin3 Polymeroi beeta-β-So: n3 joka muodostaa kiteet silkkisellä kirkkaudella.
Sitten muodostetaan lisää ammattiliittoja tuottamalla a-so-rakenne3, joka on kiteinen kiinteä neulojen muodossa, joka muistuttaa asbestia tai asbestia.
Kun alfa ja beeta sulaa tuottavat gammaa.
Molekyylipaino
80,07 g/mol
Sulamispiste
Sw3 Gamma = 16,86 ºC
Kolminkertainen
Se on lämpötila, jossa kolme fysikaalista tilaa on läsnä: kiinteä, nestemäinen ja kaasumainen. Alfa -muodossa kolminkertainen piste on 62,2 ºC, ja beetaversiossa se on 32,5 ºC.
Lämmittämällä alfa -muoto tällä on suurempi taipumus sublimoida kuin sulattaa. Sublimimar tarkoittaa siirtymistä kiinteästä tilasta soodalle suoraan, menemättä nestemäisen tilan läpi.
Kiehumispiste
Kaikki niin3 Keitä 44,8 ºC: n nopeudella.
Tiheys
Niin3 Nesteen (gamma) tiheys on 1 9225 g/cm3 20 ºC.
Niin3 Kaasumainen tiheys on 2,76 suhteessa ilmaan (ilma = 1), mikä osoittaa, että se on raskaampi kuin ilma.
Höyrynpaine
Sw3 Alfa = 73 mm Hg 25 ° C: ssa
Sw3 beeta = 344 mm Hg 25 ° C: ssa
Sw3 Gamma = 433 mm Hg 25 ° C: ssa
Tämä tarkoittaa, että gamma -muoto pyrkii haihtumaan helpommin kuin beeta ja tämä, että alfa.
Vakaus
Alfa -muoto on vakain rakenne, muut ovat metastabiilia, ts. Ne ovat vähemmän stabiileja.
Kemialliset ominaisuudet
Niin3 Reagoi energisesti veden kanssa rikkihapon H antamiseksi2Sw4. Reagoidessasi on erittäin lämpöä niin, että vesihöyry irrotetaan nopeasti seoksesta.
Altistuminen ilmalle niin3 imeä kosteutta nopeasti, säteilemällä tiheitä höyryjä.
Se on erittäin vahva kuivumisaine, tämä tarkoittaa, että se eliminoi vettä helposti muista materiaaleista.
SO: n rikki3 Sillä on affiniteetti ilmaisiin elektroneihin (ts. Elektronit, jotka eivät ole yhteydessä kahden atomin välillä), joten se pyrkii muodostamaan komplekseja yhdisteiden kanssa, joilla on niitä, kuten pyridiini, trimetyyliamiini tai dioksaani.
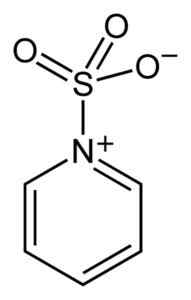 Kompleksi rikkitrioksidin ja pyridiinin välillä. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Kompleksi rikkitrioksidin ja pyridiinin välillä. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Muodostamalla komplekseja, rikki ottaa "lainan" toisen yhdisteen elektronit tyydyttääkseen näiden puuttumisensa. Rikkitrioksidia on edelleen saatavana näissä komplekseissa, joita käytetään kemiallisissa reaktioissa tarjoamaan niin3.
Se on orgaanisten yhdisteiden voimakas sulfonanttireagenssi, mikä tarkoittaa, että se auttaa lisäämään ryhmän helposti3- Molekyyleille.
Se reagoi helposti monien metallien oksidien kanssa näiden metallien sulfaattien antamiseksi.
Se on syövyttävää metalleja, eläin- ja kasvikudoksia kohtaan.
Niin3 Se on vaikeaa käsitellä useista syistä: (1) sen kiehumispiste on suhteellisen alhainen, (2) on taipumus muodostaa kiinteitä polymeerejä alle 30 ºC: n lämpötiloissa ja (3) on korkea reaktiivisuus melkein kaikkiin orgaanisiin aineisiin Ja vesi.
Voi palvella sinua: amorfiset kiinteät aineet: rakenne, ominaisuudet, esimerkitSe voi räjähtävästi polymeroitua, jos se ei sisällä stabilointia ja kosteutta on läsnä. Stabilisaattorina käytetään dimetyylisulfaattia tai boorioksidia.
Saada
Se saadaan reaktiolla 400 ºC: ssa rikkidioksidin välillä niin2 ja molekyylin happi tai2. Reaktio on kuitenkin erittäin hidasta ja tämän nopeuden lisäämiseksi tarvitaan katalyyttejä.
2 niin2 + JOMPIKUMPI2 ⇔ 2 niin3
Tätä reaktiota kiihdyttävien yhdisteiden joukossa ovat Platino Metal PT, vanadiumpentoksidi V2JOMPIKUMPI5, Rautaoksidi2JOMPIKUMPI3 ja typpioksidi.
Sovellukset
Öljynvalmistuksessa
Yksi sen tärkeimmistä sovelluksista koostuu öljyn tai savun rikkihapon valmistuksesta, jota kutsutaan siksi, että se säteilee näkyviä höyryjä paljain silmään. Sen saamiseksi niin imeytyy3 Väkevöidyssä rikkihapossa H2Sw4.
 Pu -rulfurinen oleum tai tupakointi. Näet valkoisen savun tulevan pullosta. W -. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Pu -rulfurinen oleum tai tupakointi. Näet valkoisen savun tulevan pullosta. W -. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Tämä tehdään erityisissä ruostumattomasta teräksestä valmistetuissa torneissa, joissa väkevöity rikkihappo (joka on nestemäinen)3 Kaasuma on nousussa.
Nest. Tässä on sekoitus h2Sw4 Ja niin3, Mutta siinä on myös disulfuriinihappomolekyylejä H2S2JOMPIKUMPI7 ja trisulfurinen H2S3JOMPIKUMPI10.
Kemiallisissa sulfonaatioreaktioissa
Sulfonaatio on avainprosessi laajamittaisissa teollisissa sovelluksissa pesuaineiden, pinta -aktiivisten aineiden, väriaineiden, torjunta -aineiden ja lääketuotteiden valmistukseen.
Niin3 Se toimii sulfonanttimerkkinä sulfonoitujen öljyjen ja alkyyli-angal-suljettujen pesuaineiden valmistamiseksi monien muiden yhdisteiden joukossa. Alla on aromaattisen yhdisteen sulfonaatioreaktio:
Arh + niin3 → ARSO3H
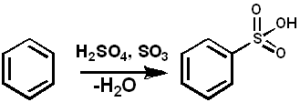 Bentseenisulfonaatio niin3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Bentseenisulfonaatio niin3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Sulfonointireaktioissa oleumia voidaan käyttää3 sen kompleksien muodossa pyridiinin tai trimetyyliamiinin kanssa muun muassa.
Metallinpoistossa
Kaasu S3 Sitä on käytetty mineraalien hoidossa. Yksinkertaisista metallioksideista voi tulla paljon liukoisempia sulfaatteja, kun niitä käsitellään niin3 suhteellisen alhaisissa lämpötiloissa.
Rikimineraalit, kuten pyriitti (rautasulfidi), traktaatti3 Sallii nämä metallit helposti ja edullisesti.
Rauta-, nikkeli- ja kuparisulfidit reagoivat niin kaasun kanssa3 Jopa huoneenlämpötilassa muodostaen vastaavat sulfaatteja, jotka ovat erittäin liukoisia ja voivat altistua muille prosesseille puhdasta metallia varten.
Useissa käyttötarkoituksissa
Niin3 Sen tarkoituksena on valmistaa kloorisulfuriinihappo, jota kutsutaan myös klorosulfonihappo HSO3Cl.
Rikkitrioksidi on erittäin voimakas hapettia ja sitä käytetään räjähtävässä valmistuksessa.
Riskejä
Terveydelle
Niin3 Se on erittäin myrkyllinen yhdiste kaikilla reiteillä, ts. Hengitys, nauttiminen ja ihon kosketus.
Irrita ja syövyttää limakalvoja. Aiheuttaa ihoa ja silmiä. Hänen höyrynsä ovat erittäin myrkyllisiä, kun ne hengitetään. Sisäisiä palovammoja tuotetaan, hengitysvaikeudet, rintakipu ja keuhkojen turvotus.
Voi palvella sinua: butanone: rakenne, ominaisuudet ja käytöt Rikkitrioksidi SO3 on erittäin syövyttävä ja vaarallinen. Kirjailija: Openicons. Lähde: Pixabay.
Rikkitrioksidi SO3 on erittäin syövyttävä ja vaarallinen. Kirjailija: Openicons. Lähde: Pixabay. Se on myrkyllistä. Sen nauttiminen tuottaa vakavaa palamista, ruokatorven ja vatsan. Lisäksi epäillään, että se on syöpää.
Tulipalo tai räjähdys
Se edustaa palovaaraa, kun se on joutunut kosketukseen orgaanisten materiaalien, kuten puun, kuitujen, paperin, öljyn, puuvillan kanssa, varsinkin jos ne ovat märkiä.
On myös riski, jos joudut kosketuksiin tukikohtien kanssa tai vähentävien aineiden kanssa. Se yhdistetään veden räjähtävästi, muodostaen rikkihappoa.
Kosketus metallien kanssa voi tuottaa vetykaasua H2 mikä on hyvin syttyvää.
Sitä tulisi välttää lasisuonissa säiliön mahdollisten väkivaltaisten repeämien estämiseksi.
Ympäristövaikutus
Niin3 Sitä pidetään yhtenä suurimmista epäpuhtauksista, jotka ovat läsnä maan ilmakehässä. Tämä johtuu sen roolista aerosolien muodostumisessa ja sen vaikutuksesta happaan sateeseen (rikkihapon H muodostumisen vuoksi2Sw4-A.
 Hapon sateen vaurioitunut metsä Tšekin tasavallassa. Lovecz [julkinen alue]. Lähde: Wikimedia Commons.
Hapon sateen vaurioitunut metsä Tšekin tasavallassa. Lovecz [julkinen alue]. Lähde: Wikimedia Commons. Niin3 Se muodostuu ilmakehässä rikkidioksidin hapettumisen vuoksi niin2. Kun niin muodostuu3 Tämä reagoi nopeasti veden kanssa rikkihapon H muodostamiseksi2Sw4. Viimeaikaisten tutkimusten mukaan on olemassa muita SOS -muutosmekanismeja3 Ilmakehässä, mutta tämän suuren määrän vettä johtuen niin otetaan edelleen huomioon3 Lähinnä muutettuna h2Sw4.
Niin3 Kaasu- tai teollisuuskaasumaista jätettä, joka sisältää sitä, ei pidä ladata ilmakehään, koska se on vaarallinen epäpuhtaus. Se on erittäin reaktiivinen kaasu ja kuten edellä on jo sanottu, ilman kosteuden läsnä ollessa3 Siitä tulee rikkihappoa H2Sw4. Siksi ilmassa niin3 jatkuu rikkihappona muodostaen pieniä pisaroita tai aerosolia.
Jos rikkihappopisarat tulevat ihmisen tai eläinten hengitystiloihin, ne kasvavat nopeasti siellä olevan kosteuden vuoksi, joten heillä on mahdollisuus tunkeutua keuhkoihin. Yksi H: n happamuoneen mekanismeista2Sw4 (tuo on niin3) Se voi tuottaa voimakasta myrkyllisyyttä, koska elävien organismien (kasvit, eläimet ja ihmisen) solunulkoinen ja solunsisäinen pH muuttuu) muutokset).
Joidenkin tutkijoiden mukaan niin sumu3 Se on syynä astmaatikkojen kasvuun Japanin alueella. Niin sumu3 Sillä on erittäin syövyttävä vaikutus metalleihin, joten ihmisen rakentamat metallirakenteet, kuten jotkut sillat ja rakenteet, voivat vaikuttaa hyvin.
Niin3 Nestettä ei pidä hylätä likaisten vesien tai viemärien viemärissä. Jos se kaadetaan viemäriin, voit luoda tulen tai räjähdysvaaran. Jos se vuotaa vahingossa, vesivirtaa ei tule suunnata tuotetta kohti. Sitä ei tule koskaan absorboida sahanpurulla tai muuhun imukykyiseen polttoaineeseen, koska se voi tuottaa tulipaloja.
Se tulisi imeytyä kuivaan hiekkaan, kuivaan maahan tai muuhun täysin kuivaan inerttiin imeytymiseen. Niin3 Sitä ei pidä kaataa ympäristöön, eikä sen pitäisi koskaan ottaa yhteyttä tähän. Se tulisi pitää kaukana vesilähteistä, koska tämän kanssa tuottaa rikkihappoa, joka on haitallista vesi- ja maa -organismeille.
Viitteet
- Sarkar, S. et al. (2019). Ammoniakin ja veden vaikutus rikkitrioksidin kohtaloon troposfäärissä: Sulfamihapon ja rikkihappojen muodostumisreittien teoreettinen tutkimus. J Phys Chem A.2019; 123 (14): 3131-3141. NCBI toipunut.Nlm.NIH.Hallitus.
- Muller, t.Lens. (2006). Rikkihappo- ja rikkitrioksidi. Kirk-OTHMER-KEMIAALISEN TEKNOLOGIA. Osa 23. Haettu verkkokirjastosta.Viiva.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Trioksidirikki. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kikuchi, r. (2001). Rikkitrioksidin ympäristön hallinta: SO: n vaikutus3 Ihmisten terveydelle. Ympäristönhallinta (2001) 27: 837. Linkki palautettu.Jousto.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Ismail, m.Yllyttää. (1979). Metallien uuttaminen sulfideista käyttämällä rikkitrioksidia fluidisoinnissa. J -. Kemia. Tekniikka. Biotekniikka. 1979, 29, 361-366. Haettu verkkokirjastosta.Viiva.com.
- « Malawi Lagon maantiede, geologia, merkitys, eläimistö, rios
- Natriumsyanidi (NACN) rakenne, ominaisuudet, riskit, käytöt »

