Bariumoksidi (BAO) rakenne, ominaisuudet, käytöt, riskit

- 1080
- 23
- Gustavo Runte DVM
Hän bariumoksidi Se on epäorgaaninen kiinteä aine, jonka muodostaa bariumiatomi (BA) ja happea (O) -atomi. Sen kemiallinen kaava on Bao. Se on valkoinen kiteinen kiinteä ja on hygroskooppinen, ts. Se imee ilman kosteutta, mutta niin se reagoi tämän kanssa.
Bariumoksidin nopea reaktio veden kanssa tekee siitä käytetyn kemiallisen analyysin laboratorioissa, ts. Veden eliminointi orgaanisista liuottimista, jotka ovat nestemäisiä yhdisteitä, jotka auttavat liuottamaan muita aineita.
 Kiinteä bao bariumoksidi. LEM [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Kiinteä bao bariumoksidi. LEM [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Bao käyttäytyy kuin vahva emäs, siksi reagoi monen tyyppisten happojen kanssa. Esimerkiksi reagoi helposti hiilidioksidin kanssa2 ilmasta bariumkarbonaatin bacchuksen muodostamiseksi3.
Se palvelee sähkökaapeleiden polymeerien valmistusta ja hartsin ainesosana parannettujen hampaiden reikien tiivistämiseksi.
Bariumoksidia (BAO) käytetään myös keraamisessa teollisuudessa, molemmat kattaakseen sen lasituksella ja sen valmistamiseksi. Sitä käytetään myös sementtiseoksissa lopputuotteen puristusvastuksen lisäämiseksi.
[TOC]
Rakenne
Bao Baar -oksidi muodostuu kationista BA2+ ja happea anioni tai2-.
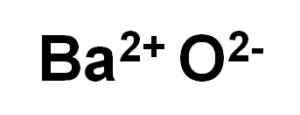 Bao Barium -oksidi -ionit. Kirjoittaja: Marilú Stea.
Bao Barium -oksidi -ionit. Kirjoittaja: Marilú Stea. Kiteissä bao muodostaa kuutiometriä ionisia verkkoja (kuution muodossa) natriumkloridityypin muodossa.
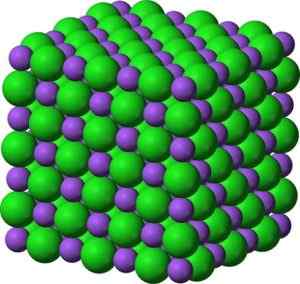 Bao bariumoksidi -muotoinen kiteinen rakenne, joka on samanlainen kuin natriumkloridi. Vihreä: Barium. Sininen: happi. Benjah-BMM27 (Talk · Action) [Julkinen alue]. Lähde: Wikimedia Commons.
Bao bariumoksidi -muotoinen kiteinen rakenne, joka on samanlainen kuin natriumkloridi. Vihreä: Barium. Sininen: happi. Benjah-BMM27 (Talk · Action) [Julkinen alue]. Lähde: Wikimedia Commons. Barium -ionin elektroninen kokoonpano on: [xe] 6s0 - No, 6S -kerroksen kaksi elektronia ovat menettäneet. Tämä kokoonpano on erittäin vakaa.
Nimikkeistö
-Bariumoksidi
-Barium -monoksidi
Se voi palvella sinua: Testi: Ominaisuudet, tyypit, esimerkit käytöstäFyysiset ominaisuudet
Fyysinen tila
Kellertävä valkoinen kiteinen kiinteä.
Molekyylipaino
153,33 g/mol
Sulamispiste
1923 ºC
Kiehumispiste
Noin 2000 ºC.
Tiheys
5,72 g/cm3
Liukoisuus
Pikku vesiliukoinen: 3,8 g/100 ml 20 ° C: ssa.
Kemialliset ominaisuudet
Bario Bao -oksidi reagoi nopeasti2, mikä on liukoisin hydroksidi alkalineeteristen metallihydroksidien välillä.
Bao + h2O → BA (OH)2
Bao on vahva pohja. Reagoi eksotermisen (ts. Lämpö irrottamisen kanssa) kaikentyyppisillä hapolla.
CO: n kanssa2 Bao reagoi muodostamaan bariumkarbonaatti bacchus3.
Bao + Co2 → Bacchus3
Bao on hygroskooppinen, koska jos se sallitaan ympäristöön, se liitetään vähitellen ilman kosteuteen, muodostaen BA: n (OH)2 joka yhdistetään hiilidioksidiin2 ilmasta, joka antaa bariumkarbonaatin bacchus3.
Kun Bao -barium -monoksidia kuumennetaan ilman läsnä ollessa, se yhdistetään happea muodostavan bariumperoksidi Bao2. Reaktio on palautuvaa.
2 bao + o2 ⇔ 2 Bao2
Veden läsnä ollessa se voi reagoida alumiinin kanssa näiden metallien oksidien tai hydroksidien FIFC Zn: n kanssa ja tuottaa vetykaasua H2.
Voit aloittaa orgaanisten yhdisteiden polymeroinnin, jotka voidaan polymeroida, kuten epoksidit.
Riskejä
Se voi olla myrkyllistä nielemällä. Sinun ei pitäisi ottaa yhteyttä ihoon. Se on ärsyttäviä silmiä, ihoa ja hengitysteitä. Se voi olla haitallista hermostolle. Se kykenee aiheuttamaan alhaisia kaliumpitoisuuksia, mikä johtaa sydämen ja lihashäiriöihin.
Saada
Bao bariumoksidi voidaan saada kuumentamalla Bario Baco -karbonaatti3 Hiilen kanssa. Bao on muodostettu ja hiilimonoksidikaasu vapautuu.
Bacchus3 + C → Bao + 2 Co ↑
Sovellukset
Orgaanisten liuottimien kuivausaineena
Baoa on helppo reagoida veden kanssa, viime vuosisadan puolivälistä lähtien bensiinin ja orgaanisten liuottimien kuivumisaineeksi.
Se voi palvella sinua: Syanhydrinen happo: molekyylirakenne, ominaisuudet, käyttötarkoituksetBao on erittäin aktiivinen kuivuminen sen ympärillä, se vie kosteuden erittäin nopeasti, melko lämmön kehityksellä muodostaen bariumhydroksidin BA (OH)2 joka on vakaa noin 1000 ºC. Siksi BAO: ta voidaan käyttää korkeissa lämpötiloissa.
Sillä on myös korkea veden imeytymiskyky. Jokaiselle BAO -molekyylille voi absorboida vesi ja BA (OH)2 Tuloksena voi myös absorboida tietyn määrän vettä.
Se sopii analyyttiseen kemian laboratorioon. Se ei ole tahmea.
Sitä voidaan käyttää kuivauspaikoissa, jotka ovat suuria lasisäiliöitä, joissa on kansi, jossa kuiva sisäinen ilmapiiri ylläpidetään. Bao pitää kuivurin miniatomosfäärin kuivana.
 Laboratorioiden erottimet. Kuivausaineen kiinteä aine, kuten bao, asetetaan pohjan pohjaan. Alkuperäinen lähettäjä oli Rifleman 82 englanniksi Wikipedia. [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons.
Laboratorioiden erottimet. Kuivausaineen kiinteä aine, kuten bao, asetetaan pohjan pohjaan. Alkuperäinen lähettäjä oli Rifleman 82 englanniksi Wikipedia. [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons. Nämä kuivuajat toimivat aineita tai reagensseja ja estävät siten imeytymästä vettä ympäristöstä.
Se myös kuivaa emäksisiä kaasuja, kuten ammoniakki NH3.
Latauslamppuissa
Bao asetetaan purkauslamppujen elektrodiin elektronina säteilevänä materiaalina.
Purkausvalaisimet muodostetaan lasiputken, kvartsin tai muun sopivan materiaalin avulla, sisältävät inertin kaasun ja useimmissa tapauksissa metallihöyry. Metallinen höyry voi olla natrium tai elohopea.
 Elohopeavalaisin. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Elohopeavalaisin. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Putken sisällä sähköiski tapahtuu, koska sillä on positiivinen ja negatiivinen elektrodi.
Bao asetetaan lamppuelektrodiin. Elektronit törmäävät metallihöyrysatomien kanssa ja välittävät energiaa.
Se voi palvella sinua: kuplioksidi (CuO)Kun ohitat sähkövirran tämän kaasun tai höyryn läpi, on näkyvä valo- tai ultraviolettisäteily (UV).
Keraamisessa valmistuksessa
BAO: ta käytetään lasitetuissa keraamisissa pinnoituskoostumuksissa.
 Pinnoitettu rakennusjulkisivu lasitetulla keramiikalla. Penny mayes/lasitettu julkisivu. Lähde: Wikimedia Commons.
Pinnoitettu rakennusjulkisivu lasitetulla keramiikalla. Penny mayes/lasitettu julkisivu. Lähde: Wikimedia Commons. Sitä on kuitenkin testattu myös lisäaineena Hobin valmistelussa.
Bao parantaa tehokkaasti tämän tyyppisiä keraamisia mekaanisia ominaisuuksia ja kemiallista vastustuskykyä. Sillä on voimakas vaikutus saatujen materiaalien kiteisen vaiheen koostumukseen ja koostumukseen.
Sementtiseosten valmistuksessa
BAO on testattu fosfoaluminaattisementin komponenttina.
Tämäntyyppinen sementti on hyödyllinen meriympäristöissä, koska sillä ei ole samaa taipumusta hydraattisesti kuin muun tyyppiset sementit, joten se ei kärsi huokosesta tai laajenemisesta.
Fosfoaluminointisementtejä on kuitenkin vahvistettava niiden mekaanisessa suorituskyvyssä kestämään merivirrat ja meressä olevat kelluvat jääkappaleet.
BAO: n lisääminen fosfoaluminaatiosementtiin muuttaa mainitun materiaalin mineraalirakennetta, parantaa huokosten rakennetta ja lisää huomattavasti sementtipastan puristusvoimaa.
Toisin sanoen Bao parantaa tämän tyyppisen sementin puristusvastusta.
 Sekoittaa betonia. Bao bariumoksidi on hyödyllinen tiettyjen sementtiominaisuuksien parantamiseksi. Thamizhpparithi maari [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Sekoittaa betonia. Bao bariumoksidi on hyödyllinen tiettyjen sementtiominaisuuksien parantamiseksi. Thamizhpparithi maari [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Useissa sovelluksissa
Sitä käytetään ainesosana hammashartsien opasiteetin aikaansaamiseksi hammaslääkäreiden suorittamien reikien täyttämiseksi, hammaslääkärit.
Sitä käytetään myös ydinmuodostusaineena polyvinylideenifluoridipolymeerien valmistukseen, joita käytetään sähkökaapeleiden eristämiseen.
Viitteet
- Partyka, J. et al. (2016). BAO: n lisäämisen vaikutus lasin keraamisten materiaalien sintraamiseen SIO: sta2-Siihen2JOMPIKUMPI3-Naa2OKEI2O-CAO/MGO -järjestelmä. J Thermal Calim (2016) 125: 1095. Linkki palautettu.Jousto.com.
- Zhang, P. et al. (2019). BAO: n vaikutus fosfoaluminaattisementin mineraalirakenteeseen ja hydraatiokäyttäytymiseen. J Thermal Calim (2019) 136: 2319. Linkki palautettu.Jousto.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Oksidibarium. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Smith, n.-Lla. (2003). Valaistus. Periaate. Sähköinsinöörin referenssikirjassa (kuusitoista painos). ScienEdirect.com.
- Ebnejjad, S. (2003). Fluoropolymeerivaahdot. PVDF -vaahtoava. Sulaa prosessoitava fluoroplastics. ScienEdirect.com.
- Booth, h.S. ja McIntyre, L.H. (1930). Bariumoksidi kuivana. Ind. Eng. Kemia. Anaali. Ed. 1930, 2, 1, 12-15. Pubista toipunut.ACS.org.
- « Natriumsyanidi (NACN) rakenne, ominaisuudet, riskit, käytöt
- 15 parasta ruokaa pakaran lisäämiseksi (luonnollinen) »

