Pyöräilyominaisuudet, reaktiot, käytöt, esimerkit
- 2213
- 524
- Dr. Travis Reichert
Se Sykloalcanos He ovat tyydyttyneiden hiilivetyjen perhe, jolla on yleinen C -kaavanH2N Se on samanaikainen alkeenien kanssa; Erolla, että ilmeinen tyydyttymättömyys ei johdu kaksoissidoksesta, vaan renkaasta tai syklistä. Siksi heitä pidetään alquenos -isomeereinä.
Nämä muodostuvat, kun lineaariset alkaanit yhdistävät ketjujensa päät suljetun rakenteen perustamiseksi. Kuten alkaanissa, sykloalcan voi osoittaa erikokoisia, molekyylimassoja, substituutioita tai jopa järjestelmiä, jotka koostuvat useammasta kuin yhdestä renkaasta (polysykliset aineet).
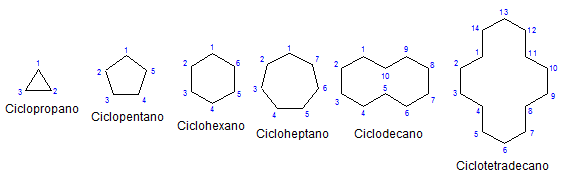
 Jotkut monosykliset sykloalcanot. Lähde: Mephisto Spa kautta Wikipedia.
Jotkut monosykliset sykloalcanot. Lähde: Mephisto Spa kautta Wikipedia. Muista, kemiasta ja fyysisesti ne ovat samanlaisia kuin alkaanit. Heillä on vain hiilejä ja vetyjä, ne ovat neutraaleja molekyylejä ja ovat siksi vuorovaikutuksessa van der -seinien voimien läpi. Ne toimivat myös polttoaineina, vapauttaen lämpöä, kun ne palaavat hapen läsnä ollessa.
Miksi sykloalcanos ovat epävakaampia kuin heidän avoimen ketjun kollegansa? Syynä voidaan epäillä tarkkailemalla ylemmässä kuvassa esitettyjä sykloalcanos -esimerkkejä: on steerisiä (alueellisia) jännitteitä ja esteitä.
Huomaa, että mitä vähemmän hiilejä (lueteltu sinisellä), sitä suljempi rakenne on; Ja päinvastainen tapahtuu, kun ne kasvavat, kääntyen kuin kaulakoru.
Pienet sykloalaanit ovat kaasumaisia, ja koska niiden koot lisäävät molekyylien välisiä voimia. Näin ollen ne voivat olla nestemäisiä, jotka kykenevät liuottamaan rasvoja ja apolaarisia, voiteluainetta tai kiinteitä aineita, jotka näyttävät tummilta väreiltä ja ominaisuuksilta, kuten asfalttivärit.
[TOC]
Fysikaaliset ja kemialliset ominaisuudet
Vastakkaisuus
Kun koostuu vain hiilistä ja hydrogeista, atomeista, jotka eivät eroa liikaa elektronegatiivisuudesta, tämä tekee sykloalc -molekyyleistä apolaarisia ja siten puuttuu dipolimomentti.
He eivät voi olla vuorovaikutuksessa dipoli-dipolivoimien kautta, mutta ne riippuvat erityisesti Lontoon voimista, jotka ovat heikkoja, mutta ne kasvavat molekyylimassalla. Siksi pienet sykloalcanot (alle viidellä hiilellä) ovat kaasumaisia.
Molekyylien väliset vuorovaikutukset
Toisaalta, koska ne ovat renkaita, sykloalcanoilla on suurempi kontakti -alue, joka suosii Lontoon joukkoja molekyyliensä keskuudessa. Siten ne on ryhmitelty ja vuorovaikutuksessa paremmin alkaaneihin verrattuna; Ja siten sen kiehumis- ja fuusiopisteet ovat korkeammat.
Lisäksi, koska heillä on kaksi vähemmän vetyatomia (CnH2N Sykloalcanosille ja cnH2N+2 Alkaanille) ne ovat kevyempiä; Ja lisäämällä tähän suurimman kontakttialueen tosiasia, vähentää sen molekyylien käyttämää tilavuutta, ja siksi ne ovat tiheämpiä.
Kylläisyys
Miksi sykloalcanos tyydyttyneinä hiilivedinä luokitellaan? Koska heillä on kuinka he sisältävät vetymolekyylin; Ellei rengas avautuu, ja siinä tapauksessa niistä tulee yksinkertaisia alkaaneja. Jotta hiilivety voidaan pitää tyydyttyneinä, sillä on oltava suurin mahdollinen C-H-linkkien lukumäärä.
Se voi palvella sinua: potentiometri (Phameter)Vakaus
Kemiallisesti ne ovat hyvin samankaltaisia kuin alkaanit. Molemmilla on C-C- ja C-H-linkit, joita ei ole niin helppo murtaa muiden tuotteiden aiheuttamiseksi. Niiden suhteellinen stabiilisuus eroaa kuitenkin, joka voidaan varmistaa kokeellisesti mittaamalla niiden palamisen (ΔHkampa-A.
Esimerkiksi verrattuna ΔHkampa Propaanille ja syklopropolle (kuvassa kuvassa) on 527,4 kcal/mol ja 498,9 kcal/mol, vastaavasti.
Yksityiskohta on, että syklopropaanikampa vähäinen (471 kcal/mol), koska ne ovat kolme metyleeniryhmää, CHO2; Mutta todellisuudessa se vapauttaa enemmän lämpöä, mikä heijastaa epävakautta suurempaa kuin arvioitu. Tämän ylimääräisen energian sanotaan, että se johtuu renkaan sisällä olevista jännitteistä.
Ja itse asiassa nämä jännitteet hallitsevat ja erottavat sykloalaanien reaktiivisuuden tai stabiilisuuden alkaanien suhteen spesifisiä reaktioita vastaan. Niin kauan kuin jännitteet eivät ole kovin korkeat, sykloalcanot ovat yleensä vakaampia kuin heidän vastaavat yläosat.
Nimikkeistö
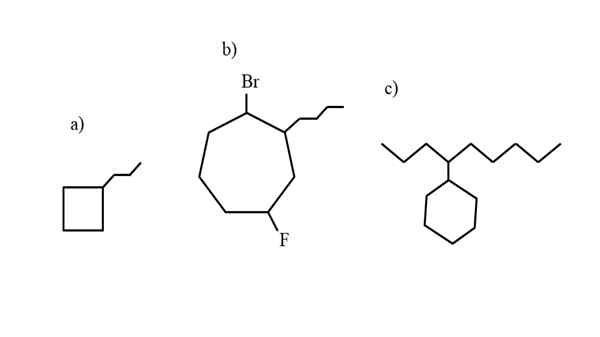 Joitakin esimerkkejä korvaavasta sykloalcanista nimikkeistösääntöjen testaamiseksi. Lähde: Gabriel Bolívar.
Joitakin esimerkkejä korvaavasta sykloalcanista nimikkeistösääntöjen testaamiseksi. Lähde: Gabriel Bolívar. IUPAC: n hallitsema nimikkeistö sykloalcanosille ei eroa liikaa kuin alkaanien. Kaikkien yksinkertaisin sääntö on sijoittaa syklin etuliite alkaanin nimeen, jonka sykloalcano muodostuu.
Siten esimerkiksi n-heksaanista, Cho3CH2CH2CH2CH2CH3, Sykloheksania saadaan (edustaa kuusikulmio ensimmäisessä kuvassa). Samalla tavalla se tapahtuu syklopropaanin, syklobutaanin jne.
Nyt nämä yhdisteet voivat kärsiä substituutioita yhdestä niiden hydrogeista. Kun renkaan hiilihiilien lukumäärä on korkeampi kuin vuokra -substituenttien, rengas pidetään pääketjuna; Näin on a) ylemmän kuvan kannalta.
Huomaa, että a) syklobutaanissa (neliö) on enemmän hiiliä kuin siihen linkitetyssä Propilus -ryhmässä; Sitten tämä yhdiste on nimeltään propyylisiklobutano.
Jos substituenttia on enemmän kuin yksi, ne tulisi nimetä aakkosjärjestyksessä ja siten, että heillä on vähiten mahdollinen paikannusnumero. Esimerkiksi b) kutsutaan: 1-BROMO-4-FLUORO-2-BUTILCICLOHEPTANO (EI 1-BROMO-5-FLUORO-7-Butyylisikloheptano, joka olisi väärä).
Ja lopuksi, kun alquilic -substituentilla on enemmän hiiliä kuin renkaassa, sanotaan silloin, että jälkimmäinen on pääketjun korvaava ryhmä. Siten c) kutsutaan: 4-sykloheksilnonano.
Voi palvella sinua: metallioksiditRakenne
Jättämättä syrjään korvattuja sykoneja, on kätevää keskittyä vain niiden rakenteellisiin emäksiin: renkaat. Nämä olivat esitetty ensimmäisessä kuvassa.
Heitä tarkkailemalla vääriä idea voi syntyä, että tällaiset molekyylit ovat tasaisia; Mutta syklopropoa lukuun ottamatta sen pinnat ovat "sikzagenantteja", hiilihiilit alaspäin tai lähettämällä suhteessa samaan tasoon.
Tämä johtuu siitä, että kaikilla hiileillä on SP -hybridisaatio3, ja siksi esiintyvät tetraedriset geometriat, joissa on 109,5º linkin kulma. Mutta jos renkaiden geometria havaitaan huolellisesti, niiden kulmien on mahdotonta; Esimerkiksi syklopropaanin kolmion kulmat ovat 60º.
Tätä kutsutaan kulmajännitykseksi. Mitä suurempi renkaat, C-C-linkkien välinen kulma on lähempänä 109,5º.
Toinen esimerkki havaitaan syklobutaanissa, jonka linkkikulut ovat 90º. Jo syklopentanossa sen kulmat ovat 108º, ja sykloheksanista sanotaan sitten, että kulmajännitys lakkaa käyttämästä niin huomattavaa vaikutusta.
Konformaatio
Kulmajännityksen lisäksi on myös muita tekijöitä, jotka vaikuttavat sykloalcanosin kokeiluun jännitykseen.
C-C-linkit eivät voi pyöriä ilman enemmän, koska tämä tarkoittaisi, että koko rakenne "tärisee". Siten nämä molekyylit voivat omaksua erittäin hyvin määriteltyjä alueellisia konformaatioita. Näiden liikkeiden tarkoituksena on vähentää vetyatomien pimennyksen aiheuttamia jännitteitä; eli kun yksi toisen edessä.
Esimerkiksi syklobutaanin konformaatiot muistuttavat perhonen, joka lyö siipiään; syklopentanon, kirjekuoren; Sykloheksanin, veneen tai tuolin ja mitä suurempi rengas, sitä suuremmat määrät ja muodot, joita he voivat käyttää avaruudessa.
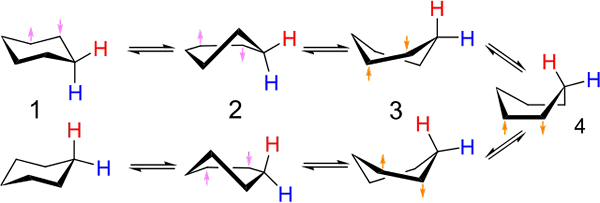 Sijoitukset tuolin ja venetyyppisten konformaatioiden välillä sykloheksaaniin. Lähde: Kministi [CC0].
Sijoitukset tuolin ja venetyyppisten konformaatioiden välillä sykloheksaaniin. Lähde: Kministi [CC0]. Ylivoimainen kuva näyttää esimerkin sykloheksaanin sellaisista konformaatioista. Huomaa, että väitetty litteä kuusikulmio näyttää todella enemmän tuolilta (kuvan vasemmalle) tai veneestä (oikea). Vetyä esitetään punaisilla sanoituksilla ja toinen sinisillä sanoituksilla, jotta ne osoittavat, kuinka niiden suhteelliset sijainnit muuttuvat sijoitusten jälkeen.
Kohdassa (1), kun vety on kohtisuorassa rengastasoon nähden, sanotaan, että se on aksiaalisessa asennossa; Ja kun se on samansuuntainen tämän kanssa, sanotaan, että se on päiväntasaajan asennossa.
Reaktiot
Reaktiot, joihin sykloalcan voi kärsiä. Molemmat palaavat ylimääräisen hapen läsnä ollessa tyypillisissä palamisreaktioissa hiilidioksidin ja veden tuottamiseksi. Samoin molemmat voivat kärsiä halogenoinnista, joissa vety korvataan halogeeniatomilla (F, Cl, BR, I).
Se voi palvella sinua: terveyskemian edut ja haitat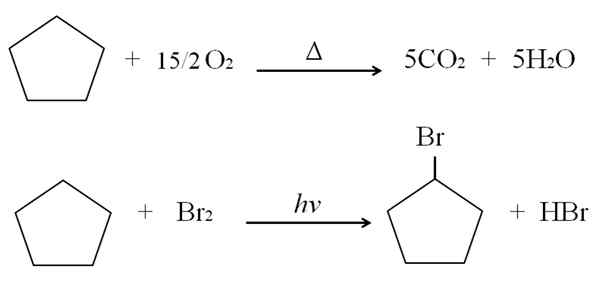 Syklopentano -reaktiot. Lähde: Gabriel Bolívar.
Syklopentano -reaktiot. Lähde: Gabriel Bolívar. Syklopentanon palamis- ja halogenointireaktioiden yläpuolella on esitetty esimerkkinä. Yksi mooli palaa lämmön läsnä ollessa ja 7,5 moolia molekyylin happea jakautumiseksi CO: ksi2 ja h2JOMPIKUMPI. Toisaalta ultravioletin ja bromin läsnä ollessa.
Sovellukset
Cycloalcanosin käyttö riippuu suurelta osin niiden hiilihajojen lukumäärästä. Kevyin ja siksi kaasumainen, kerran tarjoillaan julkisten valojen kaasulamppujen syöttämiseen.
Sillä välin nesteillä on voitto öljyjen, rasvojen tai kaupallisten tuotteiden liuottimina, jotka ovat luonteeltaan. Näistä voit mainita syklopentanon, sykloheksanin ja sykloheptaanin. Samoin niitä käytetään usein rutiininomaisissa toiminnoissa Petróleos -laboratorioissa tai polttoaineen formulaatiossa.
Jos ne ovat raskaampia, niitä voidaan käyttää voiteluaineina. Toisaalta ne voivat myös edustaa lääkkeen synteesin lähtöainetta; Kuten karboplatiini, joka sisältää rakenteessaan syklobutaanirenkaan.
Sychannel -esimerkit
Lopuksi se palautetaan artikkelin alkuun: Kuva, jossa on useita palautumattomia sykloalcanoja.
Sykloalaanien muistamiseksi riittää ajatella geometrisia hahmoja: kolmio (syklopropaani), neliö (syklobutaani), Pentagon (syklopentano), kuusikulmioon.
Mitä suurempi rengas, sitä vähemmän se muistuttaa sen vastaavaa geometrista hahmoa. On jo nähty, että syklohexan on kaikkea muuta kuin kuusikulmio; Sama tapahtuu ilmeisemmin CyclooteTradekanon kanssa (neljätoista hiilihiiliä).
Tulee kohta, jossa he käyttäytyvät kuin kaulakorut, jotka voidaan taittaa vähentämään linkkien ja pimennysten jännitteitä täysimääräisesti.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Kemian librettexts. (2. kesäkuuta 2019). Sykloalkanien nimeäminen. Palautettu: Chem.Librettexts.org
- Wikipedia. (2019). Sykloalaani. Haettu: vuonna.Wikipedia.org
- Clark Jim. (2015). Esittelee Alkaesia ja sykloalkania. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- James Ashenhurst. (2019). Konformaatiot ja sykloalkanit. Orgaaninen kemia. Toipunut: MasterorganicChemistry.com
- Fernández Germán. (S.F.-A. Cycloalcanos-Toria. Orgaaninen kemia. Toipunut: Chemicicaorganica.org

