Hiilihappo (H2CO3) rakenne, ominaisuudet, synteesi, käyttää

- 2628
- 829
- Kelly Kilback
Hän hiilihappo Se on epäorgaaninen yhdiste, vaikka onkin niitä, jotka keskustelevat siitä, että se on todella orgaanista, jonka kemiallinen kaava on H2Yhteistyö3. Siksi se on diproottinen happo, joka pystyy luovuttamaan kaksi H -ionia+ vesipitoiseen ympäristöön kahden molekyylikationien tuottamiseksi H3JOMPIKUMPI+. Häneltä syntyy hyvin tunnettuja bikarbonaatti -ioneja (HCO3-) ja karbonaatti (CO32--A.
Tämä erityinen happo, yksinkertainen, mutta samalla se liittyy järjestelmiin, joissa lukuisat lajit osallistuvat nestemäisen höyryn tasapainoon, muodostuu kahdesta epäorgaanisesta molekyylistä: vesi- ja hiilidioksidista. CO: n läsnäolo2 Havaitaan aina, että vedessä on kupla, joka nousee pintaan.
 Lasi kaasutulla vedellä, yksi yleisimmistä juomista, jotka sisältävät hiilihappoa. Lähde: Pxhere.
Lasi kaasutulla vedellä, yksi yleisimmistä juomista, jotka sisältävät hiilihappoa. Lähde: Pxhere. Tämä ilmiö nähdään säännöllisesti virvoitusjuomissa ja hiilihapotettuna vedessä.
Hiilihapotetun tai kaasutetun veden (ylivoimainen kuva) tapauksessa tällainen määrä on liuennut2 että höyryn paine on enemmän kuin kaksinkertainen ilmakehän paine. Selvittämällä sen, pullon ja ulkopinnan paine -ero vähentää CO: n liukoisuutta2, Joten kuplat, jotka lopulta pakenevat nesteestä.
Vähemmässä määrin sama asia tapahtuu missä tahansa tuoreen tai suolaisen veden massassa: kun he lämmittävät ne, he vapauttavat liuenneen CO: n pitoisuutensa2.
Kuitenkin CO2 Se ei ole vain liuennut, vaan kärsii sen molekyylistä muunnoksia, jotka tekevät siitä H: n2Yhteistyö3; Happo, jolla on hyvin pieni elämä, mutta tarpeeksi merkitsemään sen vesipitoisen liuotinympäristön pH: n pH: n, ja myös ainutlaatuinen karbonaattipuskurijärjestelmä.
[TOC]
Rakenne
Molekyyli
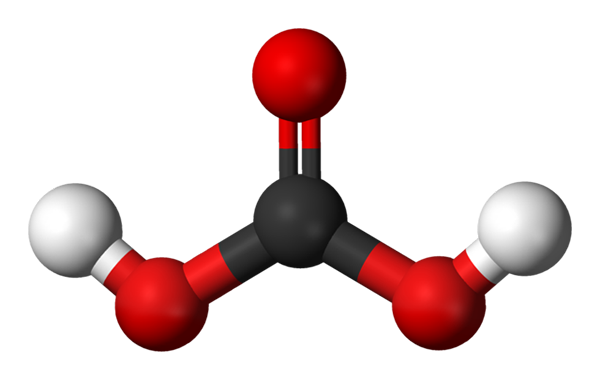 Hiilihappomolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Jynto ja Ben Mills Wikipedian kautta.
Hiilihappomolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Jynto ja Ben Mills Wikipedian kautta. Ylös meillä on H -molekyyli2Yhteistyö3, edustaa palloja ja palkkeja. Punaiset pallot vastaavat happiatomeja, mustia hiiliatomiin ja valkoisia vetyatomeja.
Huomaa, että kuvasta alkaen voit kirjoittaa uuden kelvollisen kaavan tälle hapolle: Co (OH)2, Missä CO: sta tulee karbonyyliryhmä, c = o, linkitetty kahteen hydroksyyliryhmään, OH. Kun on kaksi OH -ryhmää, jotka kykenevät luovuttamaan vetyatomeja, nyt ymmärretään, mistä H -ionit tulevat+ julkaistu keskellä.
 Hiilihapon molekyylirakenne.
Hiilihapon molekyylirakenne. Huomaa, että Formula Co (OH)2 Se voidaan kirjoittaa OHCOOH: ksi; toisin sanoen RCOOH -tyypistä, missä R: stä tulee tässä tapauksessa OH -ryhmä.
Tästä syystä se, että molekyyli koostuu happea, vety- ja hiiliatomeista, liian yleinen orgaanisessa kemiassa, jotkut pitävät joitain orgaanisena yhdisteenä. Synteesin osassa selitetään kuitenkin, miksi muut pitävät sitä epäorgaanisesta ja ei -orgaanisesta luonteesta.
Voi palvella sinua: dihydroksiasetoni: rakenne, ominaisuudet, hankkiminen, käyttöMolekyylien vuorovaikutus
Molekyylistä H2Yhteistyö3 Voidaan kommentoida, että sen geometria on trigonaalinen litteä, hiili sijaitsee kolmion keskellä. Kahdessa sen kärjessä siinä on OH -ryhmät, jotka ovat vetysillan luovuttajia; Ja jäljellä olevassa muussa ryhmän C = O happiatomilla, vety -sillan vastaanottajalla.
Siten h2Yhteistyö3 Sillä on vahva taipumus olla vuorovaikutuksessa protikoiden tai hapetettujen liuottimien (ja myös typen) kanssa.
Ja sattumalta vesi kohtaa nämä kaksi ominaisuutta, ja H: n affiniteetti on sellainen2Yhteistyö3 hänelle, joka melkein heti antaa hänelle h+ Ja hydrolyysitasapaino, johon sisältyy HCO -lajit, alkaa perustaa3- ja h3JOMPIKUMPI+.
Siksi pelkkä veden läsnäolo hajoaa hiilihappoa ja tekee sen eristyksestä puhtaana yhdisteenä liian monimutkaisena.
Puhdas hiilihappo
Palaa H -molekyyliin2Yhteistyö3, Se ei ole vain tasainen, joka pystyy luomaan vety silloja, vaan se voi myös esitellä cis-trans Isomeía; Tämä on kuvassa, että meillä on cis -isomeeri, kun kaksi h osoittavat samaan suuntaan, kun taas trans -isomeerissä he osoittaisivat vastakkaisiin suuntiin.
Cis -isomeeri on molemmista vakain, ja siksi se on ainoa, joka on yleensä edustettuna.
Puhdas kiinteä h -2Yhteistyö3 Se koostuu kiteisestä rakenteesta, joka koostuu kerroksista tai molekyyleistä, jotka ovat vuorovaikutuksessa vety silloilla. Tämän odotetaan olevan molekyyli H2Yhteistyö3 Litteä ja kolmion muotoinen. Kun sublimaaliset, sykliset hämärät ilmestyvät (H2Yhteistyö3-A2, jotka yhdistävät kaksi vety sillaa c = o - OH.
HR: n symmetria2Yhteistyö3 Sitä ei ole pystynyt määrittelemään hetkillä. Sen katsottiin kiteytyneenä kahtena polymorfina: α-H2Yhteistyö3 ja β- H2Yhteistyö3. Kuitenkin α-H2Yhteistyö3, syntetisoitu CHO: n seoksen perusteella3Cooh-co2, Osoitettiin, että se oli todella CHO3Oroh: Monometrian hiilihappohappo ster.
Ominaisuudet
Mainittiin, että h2Yhteistyö3 Se on diproottinen happo, joten voit luovuttaa kaksi H -ionia+ välineeseen, joka hyväksyy ne. Kun tämä väliaine on vettä, sen dissosiaation tai hydrolyysin yhtälöt ovat:
H2Yhteistyö3(AC) + H2Tai (l) HCO3-(AC) + H3JOMPIKUMPI+(AC) (KA1 = 2,5 × 10−4-A
HCO3-(AC) + H2Tai (l) Co32-(AC) + H3JOMPIKUMPI+(AC) (KA2 = 4,69 × 10−11-A
HCO3- Se on bikarbonaatti- tai vetykarbonaatti -anioni ja CO32- Karbonaatti -anionin. Ne osoittavat myös heidän tasapainon vakiot, ka1 ja ka2. Olla ka2 Viisi miljoonaa kertaa pienempi kuin Ka1, Co: n muodostuminen ja pitoisuus32- He ovat halveksittavia.
Joten vaikka se olisi diproottinen happo, toinen H+ Voit tuskin vapauttaa sen huomattavaksi. CO: n läsnäolo kuitenkin2 liuennut suuriin määriin riittävästi väliaineen happamiseksi; Tässä tapauksessa vesi, alentaen sen pH -arvoja (alle 7).
Voi palvella sinua: FusionHiilihaposta puhuminen viittaa käytännössä vesiliuokseen, jossa HCO -lajit ovat vallitsevia3- ja h3JOMPIKUMPI+; Sitä ei voida eristää tavanomaisilla menetelmillä, koska vähiten yritykset syrjäyttäisivät CO: n liukoisuuden tasapainon2 kuplien muodostumiseen, jotka pakenevat vedestä.
Synteesi
Liukeneminen
Hiilihappo on yksi helpoimmista yhdisteistä syntetisoimiseksi. Kuten? Yksinkertaisin menetelmä on kupla, oljen tai sorbetin avulla, ilma, jota hengitämme veden tilavuuden sisällä. Koska hengitämme pohjimmiltaan yhteistyötä2, Tämä vedessä kupla liuottaa pienen osan samasta.
Kun teemme tämän, seuraava reaktio tapahtuu:
Yhteistyö2(g) + h2Tai (l) h2Yhteistyö3(AC)
Mutta puolestaan on otettava huomioon CO: n liukoisuus2 vedessä:
Yhteistyö2g) Co2(AC)
Molemmat yhteistyökumppani2 kuin h2Tai ovat epäorgaanisia molekyylejä, niin h2Yhteistyö3 Se on epäorgaanista tämän kohdan jälkeen.
Nestemäinen tasapaino
Seurauksena on, että meillä on tasapainojärjestelmä, joka riippuu suuresti Co: n osittaisista paineista2, samoin kuin nesteen lämpötila.
Esimerkiksi, jos CO: n paine2 Se kasvaa (jos puhaltamme ilmaa enemmän voimalla sorbetin läpi), enemmän h muodostuu2Yhteistyö3 ja pH: sta tulee happamempi; koska ensimmäinen saldo siirtyy oikealle.
Toisaalta, jos lämmitämme H: n liukenemisen2Yhteistyö3, CO: n liukoisuus vähenee2 Vedessä, koska se on kaasua, ja tasapaino siirtyy sitten vasemmalle (H on vähemmän2Yhteistyö3-A. Samanlainen on, jos yritämme soveltaa tyhjiötä: CO2 Se poistuu samoin kuin vesimolekyylit, jotka siirtävät tasapainon vasemmalle.
Puhdas
Yllä oleva mahdollistaa johtopäätöksen saavuttamisen: H: n ratkaisusta2Yhteistyö3 Tätä happoa ei voida syntetisoida puhtaana kiinteänä aineena tavanomaisella menetelmällä. Se on kuitenkin tehty viime vuosisadan 90 -luvulta lähtien, alkaen kiinteistä CO -seoksista2 ja h2JOMPIKUMPI.
Tähän kiinteään seokseen2-H2Tai 50%: lla sitä pommitetaan protoneilla (tyyppinen kosminen säteily), niin että kumpikaan kahdesta komponentista ei poistu ja H: n muodostuminen tapahtuu2Yhteistyö3. Tätä tarkoitusta varten on käytetty myös CHO -seosta3Ohut2 (Muista α-H2Yhteistyö3-A.
Toinen menetelmä on tehdä sama, mutta suoraan kuivalla jäällä, ei mitään muuta.
Kolmesta menetelmästä NASA: n tutkijat voivat päästä johtopäätökseen: Jupiterin jäätelössä voi esiintyä puhdasta, kiinteää tai kaasumaista karbonihappoa, Marsin jäätiköissä ja komeetoissa, joissa sellaisia kiinteitä seoksia säteilytetään jatkuvasti kosmisissa säteissä.
Voi palvella sinua: tilavuuspipetti: Ominaisuudet, käytöt, kalibrointi ja virheetSovellukset
Hiilihappo itsessään on yhdiste, jolla ei ole hyötyä. Sen ratkaisuista voit kuitenkin valmistaa vaimennusratkaisuja HCO -ikäisensä perusteella3-/CO32- tai h2Yhteistyö3/HCO3-.
Näiden ratkaisujen ja hiilihydraasin entsyymin vaikutuksen ansiosta punasoluissa2 Hengityksessä tuotettua voidaan kuljettaa veressä keuhkoihin, missä se lopulta vapautetaan hengitettäväksi kehomme ulkopuolelle.
CO: n kupli2 Se hyödyntää juomien kaasua miellyttävä ja ominainen tunne, jonka he lähtevät kurkkuunsa juomattaessa.
Myös H: n läsnäolo2Yhteistyö3 Sillä on geologinen merkitys kalkkikiven stalaktiittien muodostumisessa, koska se liukenee ne hitaasti, kunnes ne ovat peräisin terävistä viimeistelystään.
Ja toisaalta niiden ratkaisuja voidaan käyttää metallikarbonaattien valmistamiseen; Vaikka bikarbonaattisuolaa on edullisempi ja helppokäyttöinen (NAHCO3, Esimerkiksi).
Riskejä
Hiilihapolla on niin pieni elämä normaaleissa olosuhteissa (heidän arvionsa, että noin 300 nanosekuntia), mikä on käytännössä vaaratonta ympäristölle ja eläville olentoille. Kuten aiemmin todettiin, se ei kuitenkaan tarkoita, että se ei voi aiheuttaa huolestuttavaa muutosta valtameren veden pH: ssa, mikä vaikuttaa meren eläimistöön.
Toisaalta todellinen "riski" on kaasoitetussa veden saannissa, koska CO: n määrä2 niihin liuennut on paljon suurempi kuin normaalissa vedessä. Kuitenkin ja taas ei ole tutkimuksia, jotka olisivat osoittaneet, että kaasutetun veden juominen edustaa tappavaa riskiä; Jos edes suosittelet sitä paastota ja torjumaan ruoansulatushäiriöitä.
Ainoa negatiivinen vaikutus, joka havaitaan tämän veden juodalle, on täyteyden tunne, koska heidän vatsansa ovat täynnä kaasuja. Tästä (puhumattakaan virvoitusjuomista, koska ne koostuvat paljon enemmän kuin vain hiilihappoa), voidaan sanoa, että tämä yhdiste ei ole ollenkaan myrkyllinen.
Viitteet
- Päivä, r., & Underwood, a. (1989). Kvantitatiivinen analyyttinen kemia (viides ED.-A. Pearson Prentice Hall.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). HIILIHAPPO. Haettu: vuonna.Wikipedia.org
- Danielle Reid. (2019). Hiilihappo: muodostuminen, rakenne ja kemiallinen yhtälövideo. Opiskelu. Toipunut: Opiskelu.com
- Götz Bucher & Wolfram Sander. (2014). Hiilihapon rakenteen selventäminen. Osa. 346, numero 6209, s. 544-545. Doi: 10.1126/tiede.1260117
- Lynn Yarris. (22. lokakuuta 2014). Uusia oivalluksia hiilihapposta vedessä. Berkeley Lab. Toipunut: NewsCenter.lbl.Hallitus
- Claudia Hammond. (14. syyskuuta 2015). On kuohuviini todella huono sinulle? Haettu osoitteesta: BBC.com
- Jürgen Bernard. (2014). Kiinteä ja kaasuma. Fysikaalisen kemian instituutti. Innsbruckin yliopisto.

