Molekyylirakenne Syanhydrinen happo, ominaisuudet, käyttää

- 3106
- 601
- Louis Moen
Hän hydrosyaanihappo o Vety Syanidi on orgaaninen yhdiste, jonka kemiallinen kaava on HCN. Se tunnetaan myös nimellä metanonitril.
Syanhydric -happo on väritön, erittäin myrkyllinen kaasu, joka saadaan syanideja käsitellessä hapoilla. Tämä happo sijaitsee Peact -siementen sisällä, joka tunnetaan myös monissa paikoissa persikkaksi.
 Persikan siemen, joka sisältää syanidia tai vetysyanidia, HCN: tä. Yksi.Ha [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons.
Persikan siemen, joka sisältää syanidia tai vetysyanidia, HCN: tä. Yksi.Ha [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons. Ympäristön lämpötilassa alle 25 ºC on neste ja kyseisen lämpötilan yläpuolella on kaasu. Molemmissa tapauksissa se on erittäin myrkyllinen ihmiselle, eläimille ja jopa suurin osa mikro -organismeista, joita ei ole sopeutettu siihen. Se on hyvä liuotin ioneille. Se on erittäin epävakaa, koska sillä on taipumus helposti polymeroitua.
Sitä löytyy kasvivaltiosta, joka on sisällytetty joidenkin glukosidien molekyyleihin, koska kun vihannesten entsyymit hydrolysoivat, saadaan HCN, glukoosi ja bentsaldehydi saadaan.
Nämä glukosidit ovat tiettyjen hedelmien, kuten persikoiden, aprikoosin, kirsikoiden, luumujen ja katkeran mantelin siementen sisällä, joten niitä ei tule koskaan nautittaa.
Sitä löytyy myös kasveista, kuten jonkin tyyppisistä durrasta. Lisäksi jotkut bakteerit tuottavat sen aineenvaihdunnan aikana. Sitä käytetään enimmäkseen polymeerien tuotannossa ja joissakin metallurgisissa prosesseissa.
HCN on tappava myrkky hengittämisen, nauttimisen ja kosketuksen vuoksi. Se on läsnä savukkeen savussa ja muovien ja materiaalien tulen savussa, jotka sisältävät hiiltä ja typpeä. Ilman epäpuhtautta pidetään orgaanisen materiaalin palamisen aikana planeetan laajoista alueista.
[TOC]
Molekyylirakenne ja elektroninen kokoonpano
Syanidi tai syanidihappo on kovalenttinen, molekyyliyhdiste, jossa on vetyatomi, hiili ja yksi typestä.
Hiili- ja typpiatomilla on 3 paria elektroneja, joten ne muodostavat kolminkertaisen linkin. Vety liittyy hiileen, joka tämän liiton kanssa esittelee Valencia de Cuatro ja sen täydellinen elektronit.
Typpi esittelee viisi valenciaa viidestä ja oktettinsa loppuunsaattamiseksi on pari kadonneita tai yksinäisiä elektroneja, jotka sijaitsevat sivusuunnassa.
HCN on siksi täysin lineaarinen molekyyli, pari puuttuvaa elektronia sijaitsee sivusuunnassa typessä.
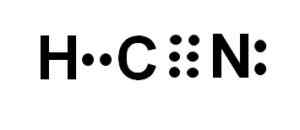 Syanhydric -hapon Lewis -esitys. Kirjoittaja: Marilú Stea.
Syanhydric -hapon Lewis -esitys. Kirjoittaja: Marilú Stea. 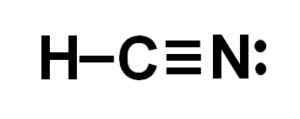 Syanidi- tai vety syanidirakenne, jossa havaitaan hiilen ja typen välinen kolminkertainen sidos. Kirjoittaja: Marilú Stea.
Syanidi- tai vety syanidirakenne, jossa havaitaan hiilen ja typen välinen kolminkertainen sidos. Kirjoittaja: Marilú Stea. Nimikkeistö
- Hydrosyaanihappo
- Vetysyanidi
- Metanonitriili
- Formonitriili
- Hydrosyaanihappo
Ominaisuudet
Fyysinen tila
Alle 25,6 ºC, jos se on vedetön ja stabiloitu, se on erittäin epävakaa ja myrkyllinen vaaleansininen neste tai sininen. Jos lämpötila on yläpuolella, on erittäin myrkyllinen väritön kaasu.
Molekyylipaino
27,03 g/mol
Sulamispiste
-13.28 ºC
Kiehumispiste
25,63 ºC (huomaa, että se kiehuu juuri ympäristön lämpötilan yläpuolelle).
Leimahduspiste
-18 ºC (suljettu kuppimenetelmä)
Itsenistuneen lämpötila
538 ºC
Voi palvella sinua: kaasukromatografiaTiheys
0,6875 g/cm3 20 ºC
Liukoisuus
Täysin sekoittuu veteen, etyylialkoholiin ja etyylieetteriin.
Dissosiaatiovakio
K = 2,1 x 10-9
Pk-lla = 9,2 (se on erittäin heikko happo)
Joitakin kemiallisia ominaisuuksia
HCN: llä on erittäin korkea dielektrisyysvakio (107 - 25 ° C). Tämä johtuu siitä, että niiden molekyylit ovat erittäin polaarisia ja niihin liittyvät vety sillat, kuten veden tapauksessa H2JOMPIKUMPI.
HCN osoittautuu hyväksi ionisoivaksi liuottimeksi, koska sillä on niin korkea dielektrisyysvakio.
Nestemäinen vedetön HCN on erittäin epävakaa, sillä on taipumus polymeroitua väkivaltaisesti. Tämän välttämiseksi lisätään stabilointiaineita pienenä prosenttimääränä h2Sw4.
Vesipitoisessa liuoksessa ja ammoniakin ja korkeapaineen adeniinimuodon läsnä ollessa yhdiste, joka on osa DNA: ta ja RNA: ta, toisin sanoen biologisesti tärkeä molekyyli.
Se on erittäin heikko happo, koska sen ionisaatiovakio on hyvin pieni, joten se on vain osittain vedessä, joka antaa syanidianionin CN: lle-. Muodosta suoloja emäksillä, mutta ei karbonaattien kanssa.
Hänen vesipitoiset liuoksensa, joita ei ole suojattu valolta4.
Liuoksessa se aiheuttaa mantelien heikkoa hajua.
Syövyttävyys
Koska se on heikko happo, se ei yleensä ole syövyttävää.
HCN -vesiliuokset, jotka sisältävät rikkihappoa stabilointinä, hyökkäävät voimakkaasti terästä yli 40 ºC: n lämpötiloissa ja ruostumattomasta teräksestä yli 80 ° C: n lämpötiloissa.
Lisäksi HCN: n laimennetut vesiliuokset voivat aiheuttaa hiiliterästä jopa huoneenlämpötilassa.
Voit myös hyökätä tietyntyyppisiin kumiin, muoveihin ja pinnoitteisiin.
Sijainti luonnossa
Se on suhteellisen runsaasti kasvien valtakunnalla, joka on osa glukosideja.
Esimerkiksi se luodaan tonsiliinistä C6H5-CH (-cn) -o-glykoosi-glykoosi, yhdiste, joka on läsnä katkerassa mantelissa. Tonsiili on syanogeeninen beeta-glukosidi, koska hydrolysoiduina se muodostaa kaksi glukoosimolekyyliä, yksi bentsaldehydistä ja yksi HCN: stä. Niitä vapauttava entsyymi on beeta-glukoksidaasi.
Tonsili löytyy persikoiden, aprikoosin, katkeran mantelin, kirsikoiden ja luumujen siemenistä.
Jotkut durran kasvit sisältävät syanogeenisen glucóside-nimisen durrina (ts. P-hydroksi- ((S) -Mandelonitrilo-beeta-d-glukosidi). Tätä yhdistettä voidaan hajottaa kahdella askeisella entsymaattisella hydrolyysillä.
Ensinnäkin durrinosa-entsyymi, joka on endogeeninen durran kasveissa hydrolys glukoosilla ja p-hydroksi- (S) -Mandelonitrilo. Sitten jälkimmäisestä tulee nopeasti vapaa HCN ja P-hydroksibentsaldehydi.
 Durran kasvi, jolla on korkea durrina -pitoisuus. Ei konetta luettavissa olevaa kirjailijaa. Pethan oletti (tekijänoikeusvaatimusten perusteella). [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikipedia Commons.
Durran kasvi, jolla on korkea durrina -pitoisuus. Ei konetta luettavissa olevaa kirjailijaa. Pethan oletti (tekijänoikeusvaatimusten perusteella). [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikipedia Commons. HCN on vastuussa durran kasvien vastustuskyvystä tuholaisille ja taudinaiheuttajille.
Tätä selitetään sillä, että durrinalla ja durrinosa -entsyymillä on erilaiset sijainnit näissä kasveissa, ja ne ovat kosketuksissa vain, kun kudokset loukkaantuvat tai tuhoutuvat, vapauttaen HCN: n ja suojaavat infektioiden kasvia, jotka saattavat tunkeutua loukkaantuneen puolueen läpi.
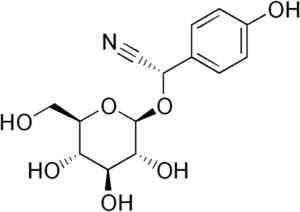 Durrina -molekyyli, jossa havaitaan kolminkertainen CN -sidos, että entsymaattisella hydrolyysillä tuottaa HCN: n. Edgar181 [julkinen alue]. Lähde: Wikipedia Commons.
Durrina -molekyyli, jossa havaitaan kolminkertainen CN -sidos, että entsymaattisella hydrolyysillä tuottaa HCN: n. Edgar181 [julkinen alue]. Lähde: Wikipedia Commons. Lisäksi jotkut ihmisen patogeeniset bakteerit, kuten Pseudomonas aeruginosa ja P. Gingivalis He tuottavat sen aineenvaihdunnan aikana.
Sovellukset
Muiden kemiallisten ja polymeerien yhdisteiden valmistuksessa
Käyttö, johon liittyy suurin osa teollisuustasolla tuotetusta HCN: stä, on välittäjien valmistus orgaaniseen synteesiin.
Voi palvella sinua: rautaoksidi (II): rakenne, nimikkeistö, ominaisuudet, käyttötarkoituksetSitä käytetään adiponitriilisynteesissä NC- (CH2-A4-CN, jota käytetään nylonin tai nylonin, polyamidin valmistamiseen. Sen tarkoituksena on myös valmistaa Acrilonitrilo tai Cianoetyleen Cho2= CH-CN, jota käytetään akryyli- ja muovikuitujen valmistamiseen.
Sen johdannaista natriumsyanidia käytetään kullan talteenottoon tämän metallin louhinnassa.
Toinen sen johdannaisista Clcn Cyanogen -kloridista palvelee torjunta -aineiden kaavoja.
HCN: tä käytetään kelatoivien aineiden, kuten EDTA: n (Etylen-diamino-tetra-asetato) valmistukseen.
Se palvelee ferrosyanidien ja joidenkin lääketuotteiden valmistuksessa.
Erilaisia käyttötarkoituksia
HCN -kaasua on käytetty hyönteismyrkkynä, sienitautien ja desinfiointiaineena, laiva- ja rakennusten kuristamiseen. Myös huonekalujen haisemiseksi niiden palauttamiseksi.
HCN: tä on käytetty metallilakassa.
Hänen erittäin korkean myrkyllisyytensä vuoksi hänet nimitettiin kemiallisen sodan edustajaksi.
Maataloudessa
Sitä on käytetty hedelmätarhoissa rikkakasvien torjunta -aineena ja torjunta -aineena. Hänellä oli käytetty sitruspuiden asteikkojen ja muiden patogeenien hallintaan, mutta jotkut näistä tuholaisista ovat tulleet kestäviksi HCN: lle.
Sitä on käytetty myös vilja -siilojen haisemiseen. Alueella valmistettua kaasumaista HCN: tä on käytetty vehnänjyvien kuristamiseen niiden säilyttämiseksi tuholaisista, kuten hyönteistä, sienistä ja jyrsijöistä. Tätä käyttöä varten on välttämätöntä, että siemenet, jotka on fumisoitu torjunta -aineen kanssa.
Vehnänsiementen fumigoivat testit on tehty HCN: n kanssa, ja on havaittu, että näiden itävyyspotentiaali ei vaikuta negatiivisesti, vaan näyttää siltä, että se suosii sitä.
Suuret HCN -annokset voivat kuitenkin vähentää merkittävästi pienten lehtien pituutta, jotka itävät siemenestä.
Toisaalta johtuen siitä, että se on voimakas nemaattinen ja että joillakin durran kasveilla on se kudoksissaan, durran kasvien potentiaalia tutkitaan käytettäväksi biohuoltavan vihreän lannoitteena.
Sen käyttö parantaisi maaperää, tukahduttamaan rikkakasveja ja kontrollitauteja ja fytoparasiittisten nematodien aiheuttamia vaurioita.
Riskejä
Ihmisen kannalta HCN on tappava myrkky kaikilla reiteillä: hengittäminen, nauttiminen ja kosketus.
 Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. Hengitettävä voi olla tappava. Arvioidaan, että noin 60-70% väestöstä voi havaita katkeran HCN-mantelien hajun, kun se on ilmassa 1-5 ppm -pitoisuudessa.
Mutta väestöstä on 20%, jotka eivät vieläkään pysty havaitsemaan sitä tappavilla pitoisuuksilla geneettisesti kyvyttömäksi tekemään niin.
Nielty on akuutti ja välitön toimintamyrkky.
Jos ratkaisut joutuvat kosketuksiin ihon kanssa, liittyvä syanidi voi olla tappava.
HCN on läsnä savukkeen savussa ja se syntyy, kun typpeä sisältävä muovit poltetaan.
Tappava toimintamekanismi organismissa
Se on kemikaali ja on nopeasti myrkyllinen, johtaa usein kuolemaan. Organismiin saapuessaan se liittyy metalloentsyymeihin (entsyymit, jotka sisältävät metalli -ionin) inaktivoimaan ne. Se on myrkyllinen aine useille ihmiskehon elimille
Sen tärkein myrkyllinen vaikutus koostuu solujen hengityksen estämisestä, koska se deaktivoi entsyymin, joka vaikuttaa fosforylaatioon mitokondrioissa, jotka ovat muun muassa puuttuvia organelleja, jotka ovat muun muassa solujen hengityselinten toiminnassa.
Voi palvella sinua: kaliumpermanganaatti (KMNO4)Savukkeen savun riski
HCN on läsnä savukkeen savussa.
Vaikka monet ihmiset tietävät HCN: n myrkytyksen vaikutuksen, harvat ymmärtävät, että he ovat alttiina heidän haitallisille vaikutuksilleen savukkeen savua kautta.
HCN on yksi useiden solujen hengitysentsyymien estämisen syistä. Savukkeen savussa läsnä olevan HCN: n määrällä on haitallinen vaikutus hermostoon.
HCN -tasot on ilmoitettu savukkeen savussa 10 - 400 μg savuketta savun suhteen ja 0,006 - 0,27 μg/savuke sekundaarista hengitystä varten (passiivinen tupakoitsija). HCN tuottaa myrkyllisiä vaikutuksia 40 μm: stä eteenpäin.
 Kirjoittaja: Alexas Photos. Lähde: Pixabay.
Kirjoittaja: Alexas Photos. Lähde: Pixabay. Hengitetään nopeasti verenkiertoon, missä hän vapautuu plasmassa tai sitoutuu hemoglobiiniin. Pieni osa kääntyy Tiocianatoksi ja erittyy virtsaan.
HCN -lämmitysriskit
Pitkäaikainen altistuminen nestemäisen HCN: n lämmölle suljetuissa astioissa voi aiheuttaa näiden väkivaltaisia ja odottamattomia repeämiä. Se voi räjähtävästi polymeroida 50-60 ºC: n alkalien jälkien läsnä ollessa ja estäjien puuttuessa.
HCN: n läsnäolo tulen savussa
HCN vapautuu typpeä sisältävien polymeerien palamisen aikana, kuten mm. Nämä materiaalit ovat läsnä kodeissamme ja useimmissa ihmisen toiminnan paikoissa.
Tästä syystä tulipalojen aikana HCN voi olla kuoleman syy hengittämällä.
Ilmakehän pilaava aine
HCN on troposfäärin epäpuhtaus. Se on resistentti fotovarsille ja ilmakehän ympäristöolosuhteissa ei kärsi hydrolyysistä.
OH -hydroksyyliradikaalit • Tuotetut fotokemiallisesti voi reagoida HCN: n kanssa, mutta reaktio on erittäin hidas, joten HCN: n puoliikä ilmakehässä on 2 vuotta.
Kun biomassan palaa, erityisesti väkijoukko, HCN vapautuu ilmakehään ja myös teollisuuden toiminnan aikana. Turveen palaminen on kuitenkin 5-10 kertaa enemmän saastuttavaa kuin muun tyyppisen biomassan polttaminen.
Jotkut tutkijat ovat havainneet, että El Niño -ilmiön aiheuttamat korkeat lämpötilat ja kuivut tietyillä planeetan ACACERB -alueilla.
 Kirjoittaja: Steve Buissinne. Lähde: Pixabay.
Kirjoittaja: Steve Buissinne. Lähde: Pixabay. Tämä johtaa intensiiviseen biomassan palamiseen kuivilla asemilla.
Nämä tapahtumat ovat troposfäärin korkeiden HCN -pitoisuuksien lähde, jotka lopulta kuljetetaan alhaiseen stratosfääriin, jäljellä.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Vetysyanidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Gidlow, D. (2017). Vety syanidi-päivitys. Työhön lääketiede 2017; 67: 662-663. NCBI toipunut.Nlm.NIH.Hallitus.
- Van Nostrandin tieteellinen tietosanakirja. (2005). Vetysyanidi. 9th Haettu verkkokirjastosta.Viiva.com.
- Ren, ja.-Lens. et al. (1996). Vetyä syanidin ja karbonyylisulfidin vaikutus vehnän itävyyteen ja luumuun. Torjunta. Sci. 1996, 47, 1-5. Haettu verkkokirjastosta.Viiva.com.
- Nicolasta, G.R -. et al. (2011). Yksinkertaiseen analyyttiseen menetelmään dhurriinipitoisuuden arviointiin syanogeenisissä kasveissa niiden käyttöä varten ja biofumigointia. J -. Maatalous-. Elintarvikekemia. 2011, 59, 8065-8069. Pubista toipunut.ACS.org.
- Sheese, P.JA. et al. (2017). Vetyjen globaali paraneminen alemmassa stratosfäärissä 2016. Geophys. Naudanliha. Letti., 44, 5791-5797. Toipunut Agupubsista.Verkkokirjasto.Viiva.com.
- Surleva, a.R -. ja drochioiu, g. (2013). Visualisointi Tupakoinnin vaara: Yksinkertainen spektrofotometrinen hydyn syanidin määritys savukkeen savussa ja suodattimissa. J -. Kemia. Koulutus. 2013, 90, 1654-1657. Pubista toipunut.ACS.org.
- Alarie, ja. et al. (1990). Vety syanidin rooli ihmisen kuolemissa tulessa. Tulessa ja polymeereissä. Luku 3. ACS -symposium -sarja. Pubista toipunut.ACS.org.
- « Kromihapporakenne, ominaisuudet, hankkiminen, käyttää
- 8 kokeilua erittäin kiistanalaisten ihmisten kanssa »

