Kromihapporakenne, ominaisuudet, hankkiminen, käyttää

- 616
- 69
- Ronald Reilly
Hän kromihappo tai h2Kro4 Kromioksidiin (VI) tai CRO Cromic -oksidiin liittyvä happo on teoreettisesti3. Tämä nimellisarvo johtuu siitä, että kromioksidin happamissa vesiliuoksissa laji H2Kro4 Sitä on läsnä muiden kromilajien kanssa (VI).
Kromioksidi3 Sitä kutsutaan myös vedettömäksi kromihapoksi. CRO3 Se on punertava tai violetti ruskea2Cr2JOMPIKUMPI7 Rikkihappon H2Sw4.
 Cromic Oxids murskaa3 Sulamiskantissa. Rando Tuikene [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons.
Cromic Oxids murskaa3 Sulamiskantissa. Rando Tuikene [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons. Vesipitoiset kromioksidiliuokset kokevat tiettyjen kemiallisten lajien tasapainon, jonka pitoisuus riippuu liuoksen pH: sta. Perus pH hallitsee kromaatti -ionit CRO42-, Kun taas HCRO -happo -ionit ovat vallitsevia4- ja cr dicromato2JOMPIKUMPI72-. On arvioitu, että happahapoa on myös kromihappo H2Kro4.
Suuren hapettumisvoimansa vuoksi kromihappoliuoksia käytetään orgaanisessa kemiassa hapetusreaktioiden suorittamiseen. Niitä käytetään myös sähkökemiallisissa prosesseissa metallien hoitamiseksi niin, että ne saavat vastuskorroosion ja kulumisen vastustuskykyä.
Tietyt polymeerimateriaalit käsitellään myös kromihapolla niiden tarttumisen parantamiseksi metalleihin, maalauksiin ja muihin aineisiin.
Kromihappoliuokset ovat erittäin vaarallisia sekä ihmisille että useimmille eläimille ja ympäristölle. Tästä syystä nestemäisiä tai kiinteitä prosesseja jätteitä, joissa käytetään kromihappoa.
[TOC]
Rakenne
Kromihappomolekyyli H2Kro4 Sen muodostuu cromato -cro -ionista42- ja kaksi vety -ionia H+ Yhtenäinen tähän. Kromaatti -ionissa kromielementti on +6 hapetustilassa.
Kromaatti -ionin alueellinen rakenne on tetraedrinen, missä kromi on keskellä ja happi miehittää tetraedron neljä kärkiä.
Kromihappovetyatomeissa ovat kumpikin hapen vieressä. Neljästä kromisidoksesta happiatomien kanssa, kaksi on kaksinkertainen ja kaksi on yksinkertaista, koska niiden hydrogens on yhdistynyt niihin.
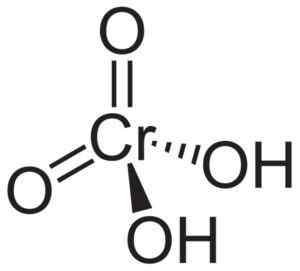 Kromihapporakenne H2Kro4 missä havaitaan kromaatin tetraedrinen muoto ja sen kaksoissidokset. Neurooteker [julkinen alue]. Lähde: Wikipedia Commons.
Kromihapporakenne H2Kro4 missä havaitaan kromaatin tetraedrinen muoto ja sen kaksoissidokset. Neurooteker [julkinen alue]. Lähde: Wikipedia Commons. Toisaalta CRO -CCORIC -oksidi3 Siinä on hapettuminen kromiatomi +6, jota ympäröivät vain kolme happiatomia.
Nimikkeistö
- Kromihappo H2Kro4
- Tetraokskromiinihappo H2Kro4
- Cromic -oksidi (vedetön kromihappo) CRO3
- Kromitrioksidi (vedetön kromihappo) CRO3
Ominaisuudet
Fyysinen tila
Anhydro- tai kromioksidikromihappo on kiteinen kiinteä purppura punainen
Molekyylipaino
Kro3: 118,01 g/mol
Sulamispiste
Kro3: 196 ºC
Sulamispisteen yläpuolella on termisesti epävakaa, se menettää happea (se vähenee) kromioksidin (III) CR: n antamiseksi2JOMPIKUMPI3. Se hajoaa noin 250 ºC: n nopeudella.
Tiheys
Kro3: 1,67-2,82 g/cm3
Liukoisuus
CRO3 Se on hyvin liukoinen veteen: 169 g/100 g vettä 25 ° C: ssa.
Se liukenee mineraalihapoihin, kuten rikki- ja typpiin. Alkoholiliukoinen.
Muut ominaisuudet
CRO3 Se on erittäin hygroskooppinen, sen kiteet ovat herkullisia.
Kun CRO3 Se liukenee vesissä vahvasti happamat liuokset.
Voi palvella sinua: titaani: historia, rakenne, ominaisuudet, reaktiot, käyttötarkoituksetSe on erittäin voimakas hapettiminen. Oxy voimakkaasti orgaaninen aine melkein kaikissa muodoissaan. Hyökkää kankaalle, nahkalle ja muoville. Useimmat metallit hyökkäävät myös.
Se on voimakkaasti myrkyllinen ja erittäin ärsyttävä sen suuren hapettumispotentiaalin vuoksi.
Vesipitoisten liuosten kemia, jossa kromihappoa on läsnä
Kromioksidi3 Se liukenee nopeasti veteen. Vesipitoisessa liuoksessa kromi (VI) voi esiintyä erilaisissa ionisissa muodoissa.
PH> 6,5 tai alkalisessa liuoksessa kromi (VI) saa Cromato -ionin muodon42- keltainen.
Jos pH vähenee (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , jotka voivat dimeroida ion dicromato cr2JOMPIKUMPI72-, Ja liuoksesta tulee oranssi. PH: ssa välillä 2,5 - 5,5, hallitsevat lajit ovat HCRO4- ja cr2JOMPIKUMPI72-.
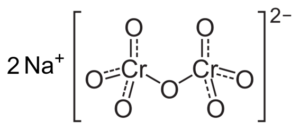 Cr dikromaatti -ionirakenne2JOMPIKUMPI72- joka on kahden natrium -Na -ionin vieressä+. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons.
Cr dikromaatti -ionirakenne2JOMPIKUMPI72- joka on kahden natrium -Na -ionin vieressä+. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons. Näissä ratkaisuissa tapahtuvat saldot, kun pH laskee, ovat seuraavat:
Kro42- (kromaatti -ioni) + h+ HCRO4-
HCRO4- + H+ H2Kro4 (kromihappo)
2hcro4- ⇔ Cr2JOMPIKUMPI72- (Dikromaatti -ioni) + h2JOMPIKUMPI
Nämä saldot tapahtuvat vain, jos happo, joka lisätään alentamaan pH: ta, on3 tai hclo4, Koska muiden happojen kanssa muodostuu erilaisia yhdisteitä.
Dikromaatin happamat liuokset ovat erittäin energisiä hapettavia aineita. Mutta alkalisissa liuoksissa kromaatti -ioni on paljon vähemmän hapettunut.
Saada
Kuultujen lähteiden mukaan yksi tapa saada CRO Cromic -oksidi3, Tämä koostuu rikkihapon lisäämisestä natrium- tai kaliumdikromaatin vesiliuokseen, joka muodostaa punaisen oranssin sakan.
 Cromic -oksidi hydratoitu tai kromihappo. Häntä [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons.
Cromic -oksidi hydratoitu tai kromihappo. Häntä [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons. Kromihappo H2Kro4 Sitä löytyy vesipitoisista kromioksidiliuoksista happamassa väliaineessa.
Kromihappo käyttää
Kemiallisten yhdisteiden hapettumisessa
Kromihappoa on käytetty voimakkaasti hapettumiskapasiteettiaan pitkään ja onnistuneesti orgaanisten ja epäorgaanisten yhdisteiden hapettamiseksi.
Lukemattomien esimerkkien joukossa ovat seuraavat: se mahdollistaa primaaristen alkoholien hapettavan aldehydojen ja näiden karboksyylihappojen, ketoneiden sekundaaristen alkoholien, tolueenin bentsoehappojen, etyylibentseenin asetofenoniin, trifenyylimetanoon trifenyylikarbinoliin, formic happea A co -co2, oksaalihappo CO: lle2, maitohappo asetaldehydille ja CO: lle2, Rauta-2+ Rautatieto usko3+, Ionjodidi jodille jne.
Mahdollistaa typpikilpailun muuntamisen nitrokokouksiin, sulfideiksi sulfoniksi. Se puuttuu ketonien synteesiin, joka perustuu alkeeniin, hapettuneina hydroboroidut alkeenit ketoneihin.
Yhdisteet, jotka ovat erittäin resistenttejä tavallisille hapettimille, kuten happi tai2 tai vetyperoksidi H2JOMPIKUMPI2, Ne hapettuu kromihapolla. Näin on tiettyjen heterosyklisten bastessien tapaus.
Metallilanodisaatioprosesseissa
Kromihapon anodisointi on sähkökemiallinen käsittely, jota sovelletaan alumiiniin suojaamaan sitä monien vuosien ajan hapettumiselta, korroosiolta ja kulumiselta.
Anodisointiprosessiin sisältyy alumiinioksidin tai alumiinioksidin kerroksen sähkökemiallinen muodostuminen metalliin. Tämä kerros suljetaan sitten kuumaan veteen, joka saavutetaan muuntamalla trihydratoituneeksi alumiinioksidiksi.
Suljettu oksidikerros on paksu, mutta se on rakenteellisesti heikko eikä ole kovin tyydyttävä seuraaville liimayhteisöille. Lisäämällä kuitenkin pienen määrän kromihappoa tiivistykseen veteen, kehitetään pinta, joka voi muodostaa hyviä sidoksia.
Voi palvella sinua: Aineen säilyttämistä koskeva lakiKromihappo veden tiivistämisessä liukenee osa paksun tyyppisestä solurakenteesta ja jättää ohuen, voimakkaan, tiukasti kiinnittyneen alumiinioksidiin, johon liimat tarttuvat ja muodostavat vahvat ja kestävät nivelet.
Anodisaatio kromihapolla koskee myös titaania ja sen seoksia.
Kemiallisissa muuntamiskäsittelyissä
Kromihappoa käytetään metallipinnoitusprosesseissa kemiallisella muuntamisella.
Tämän prosessin aikana metallit upotetaan kromihappoliuoksiin. Tämä reagoi ja liuottaa osittain pinnan kerrostumisen samanaikaisesti ohut kerros kompleksisia kromikilpikoita, jotka ovat vuorovaikutuksessa alaosan kanssa.
Tätä prosessia kutsutaan Chromat Conversion -päällyste- tai muuntamiskromiksi.
Metallit, joille yleensä altistetaan muuntamiskromi, ovat erityyppisiä terästä, kuten hiiliterästä, ruostumattomasta teräksestä ja sinkkipäällystetyistä teräksistä, ja useita ei -rautametalleja, kuten magnesiumseoksia, tinaseoksia, alumiiniseoksia, kuparia, kadmiumia, kadmiumia, kadmiumia mangaani ja hopea.
Tämä käsittely tarjoaa korroosio- ja kirkkaudenkestävyyttä metalleille. Prosessin korkeampi pH suurempi korroosion vastustuskyky. Lämpötila kiihdyttää happoreaktiota.
Eri värien päällystettä voidaan levittää, kuten sininen, musta, kulta, keltainen ja läpinäkyvä. Se tarjoaa myös metallin pinnan paremman tarttumisen kohti maalauksia ja liimoja.
Heikentyneellä tai hienonnettulla pinnalla
Kromihappoliuoksia käytetään kestomuovimateriaalin, termosystointipolymeerien ja elastomeerien pinnan valmistuksessa myöhempää pinnoittoa varten maalauksilla tai liimoilla.
H2Kro4 saavuttaa vaikutuksen pintakemiaan ja sen rakenteeseen, koska se auttaa lisäämään sen karheutta. Puremien ja hapettumisen yhdistelmä lisää liimojen tunkeutumista ja voi jopa aiheuttaa muutoksia polymeerin ominaisuuksissa.
Sitä on käytetty pienen tiheyden, korkean tiheyden ja polypropeenin lineaarisen polyeteenin haarautuneen polyeteenin vähentämiseen.
Sitä käytetään paljon elektro-receipt- tai galvanoplastian teollisuudessa metallipolymeerin tarttumisen helpottamiseksi.
Useissa käyttötarkoituksissa
Kromihappoa käytetään puisen säilöntäaineena, myös magneettisissa materiaaleissa ja kemiallisissa reaktioissa katalyysi.
Crominiinihapon palautuminen
On monia prosesseja, jotka käyttävät kromihappoa ja tuottavat virtauksia tai jäännöksiä, jotka sisältävät kromia (III), joita ei voida hylätä, koska niillä on kromi -ioneja (VI), jotka ovat erittäin myrkyllisiä tai uudelleenkäyttöisiä, koska kromaatti -ionien pitoisuus on erittäin alhainen.
Sen sijoittaminen vaatii kromaattien kemiallisen vähentämisen kromiin (III), jota seuraa hydroksidi ja suodatussateet, jotka aiheuttavat lisäkustannuksia.
Tästä syystä kromaattien poistamiseksi ja palauttamiseksi on tutkittu erilaisia menetelmiä. Tässä on joitain näistä.
Hartsien käytön kautta
Monien vuosien ajan kromatin saastunutta vedenkäsittelyä varten on käytetty ioninvaihtohartseja. Tämä on yksi Yhdysvaltain ympäristönsuojeluviraston tai EPA: n hyväksymistä hoidoista (lyhenne englanniksi Ympäristönsuojeluvirasto-A.
Tämä menetelmä mahdollistaa konsentroitun kromihapon palautumisen, koska se regeneroituu jälleen hartsista.
Hartsit voivat olla vahvoja tai heikkoja pohjaa. Voimakkaasti perushartsissa kromaatti voidaan poistaa HCRO -ioneina4- ja cr2JOMPIKUMPI72- Ne vaihdetaan OH -ioneilla- ja cl-. Esimerkiksi heikosti emäksisissä hartsissa ionit vaihdetaan SOS: lla42-.
Voi palvella sinua: nepelometriaVoimakkaasti perushartsien R- (OH) tapauksessa globaalit reaktiot ovat seuraavat:
2ROH + HCRO4- + H+ ⇔ r2Kro4 + 2H2JOMPIKUMPI
R -2Kro4 + 2hcro4- ⇔ 2RHCRO4 + Kro42-
R -2Kro4 + HCRO4- + H+ ⇔ r2Cr2JOMPIKUMPI7 + H2JOMPIKUMPI
Jokaiselle r: n molelle2Kro4 Yhden mol Cr (vi) -liuoksen muuntaminen poistetaan, mikä tekee tästä menetelmästä erittäin houkuttelevan.
Kromaattien poistamisen jälkeen hartsia käsitellään voimakkaasti alkalisella liuoksella niiden uudistamiseksi turvallisessa paikassa. Sitten kromaatit muunnetaan konsentroituneeksi kromihapoksi uudelleen.
Sähkökemiallisen uudistumisen kautta
Toinen menetelmä on kromihapon sähkökemiallinen regeneraatio, joka on myös erittäin kätevä vaihtoehto. Tämän menettelyn avulla kromi (III) hapettuu hapettuneeksi kromiksi (VI). Anodimateriaali näissä tapauksissa on edullisesti johtava dioksidi.
Mikro -organismien käyttö kromihappojen jätevesien puhdistamiseen
Menetelmä, jota on tutkittu ja jota on edelleen tutkittu, on mikro -organismien käyttö, joka on luonnollisesti tietyissä kuusiarvoisissa kromi -ioneissa saastuneissa jätevesissä, jotka ovat kromihappoliuosten sisältöä.
 Ympäristön haitalliset jätevesi. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay.
Ympäristön haitalliset jätevesi. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay. Näin on tiettyjen bakteerien, jotka ovat läsnä parkitusjätevesillä. Näitä mikrobeja on tutkittu ja määritetty, että ne ovat resistenttejä kromaateille ja kykenevät myös vähentämään kromia (VI) kromiksi (III), mikä on paljon vähemmän haitallista ympäristölle ja eläville olennoille.
Tästä syystä arvioidaan, että niitä voidaan käyttää ympäristöystävällisenä menetelmänä kromihapolla saastuneiden jätevesien korjaamiseksi ja vieroitus.
Kromihapporiskit ja kromioksidi
CRO3 Se ei ole polttoainetta, mutta voi tehostaa muiden aineiden palamista. Monet reaktiosi voivat aiheuttaa tulen tai räjähdyksen.
CRO3 ja kromihappoliuokset ovat voimakkaita ärsyttäviä ihoa (ne voivat aiheuttaa ihottumaa), silmiä (voivat polttaa ne) ja limakalvoja (voivat aiheuttaa keuhkoputken) ja voivat aiheuttaa niin kutsutun "kromikehän".
Kromiyhdisteet (VI), kuten kromihappo ja kromioksidi, ovat vakavasti myrkyllisiä, mutageenisia ja syöpää aiheuttavia useimpien elävien olentojen kannalta.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kromihappo. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wegman, r.F. ja Van Twisk, J. (2013). Alumiini- ja alumiiniseokset. 2.5. Kromihappoanodisointiprosessi. Pinnan valmistustekniikassa liima -sitoutumiseen (toinen painos). ScienEdirect.com.
- Wegman, r.F. ja Van Twisk, J. (2013). Magnesium. 6.4. Magnesiumin ja magnesiumseosten valmistus kromihappokäsittelyprosessien avulla. Pinnan valmistustekniikassa liima -sitoutumiseen (toinen painos). ScienEdirect.com.
- Grot, W. (2011). Sovellukset. 5.1.8. Kromihappojen regeneraatio. Fluoratuissa ionomeereissä (toinen painos). ScienEdirect.com.
- Swift, k.G. ja Booker, J.D -d. (2013). Pintatekniikkaprosessi. 9.7. Kromaattava. Valmistusprosessin valintakäsikirja. ScienEdirect.com.
- Poulson, a.H.C. et al. (2019). Pintamuutostekniikat PEEK: stä, mukaan lukien plasman pintakäsittely. yksitoista.3.2.1. Pinta -syövytys. Peek Biomaterials Handbook (toinen painos). ScienEdirect.com.
- Westheimer, f.H. (1949). Kromihapon hapettumisen mekanismit. Kemialliset arvostelut 1949, 45, 3, 419-451. Pubista toipunut.ACS.org.
- Tan, h.K -k -.S. (1999). Kromihapposeionin vaihto anioninvaihdolla. Kanadalainen Journal of Chemical Engineering, osa 77, helmikuu 1999. Haettu verkkokirjastosta.Viiva.com.
- Kabir, m.M. et al. (2018). Kromin (VI) vähentävien bakteerien eristäminen ja ominaispiirteet parkituslaitoksista ja kiinteistä jätteistä. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI toipunut.Nlm.NIH.Hallitus.
- « Teollisuusmaiseman ominaisuudet, elementit ja esimerkit
- Molekyylirakenne Syanhydrinen happo, ominaisuudet, käyttää »

