Mikä on disulfurinen mikä on, rakenne, ominaisuudet, käyttää
- 3086
- 28
- Gabriel Fahey
Mikä on disulfuriinihappo?
Hän disulfurihappo Se on yksi monista rikkioksoasideista, joiden kemiallinen kaava on H2S2JOMPIKUMPI7. Kaava osoittaa nimenomaisesti, että rikiatomia on kaksi, ja kuten sen nimi myös huomauttaa, siellä on oltava kaksi H -molekyyliä2Sw4 Vain yksi; Happea on kuitenkin kahdeksan sijasta, joten rikki on oltava kolme.
Tämä happo on yksi öljyn pääkomponenteista (tai savun rikkihapposta), josta tulee "tiheää" rikkihapon muoto. Tällainen on niiden hallinta, jota jotkut pitävät öljyä disulfuriinihapon synonyyminä; joka tunnetaan myös pyrosulfuriinihapon perinteisellä nimellä.
Kuvassa esitetään vastaanottaja, jolla on öljyä, rikkitrioksidin pitoisuudella, niin3, 20 %. Tälle aineelle on ominaista öljyinen ja väritön; Vaikka kellertävä tai ruskea voi tulla keltainen SO: n pitoisuudesta riippuen3 ja joidenkin epäpuhtauksien läsnäolo.
Yllä oleva kertoo SO: n osallistumisesta3 h2S2JOMPIKUMPI7; eli H -molekyyli2Sw4 Reagoi yhden kanssa3 Muodostaa disulfuriinihappo. Silloin h, h2S2JOMPIKUMPI7 Se voidaan kirjoittaa myös h2Sw4· SW3.
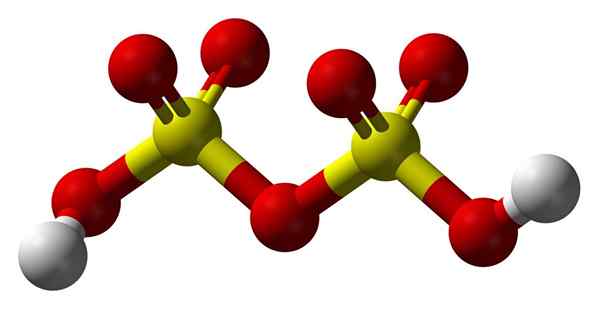
Disulfuriinihapon rakenne
 Disulfuriinihapon rakenne
Disulfuriinihapon rakenne Ylöspäin2S2JOMPIKUMPI7 Pallo- ja baarimallissa. Huomaa molekyylin symmetria: happisillan vasen puoli on identtinen oikean kanssa. Tästä näkökulmasta rakenne voidaan kuvata HO -kaavalla3Mitäänsanomaton3H.
Molemmissa päissä on jokainen hydroksyyliryhmä, jonka vety, kaikkien näiden happiatomien induktiivisella vaikutuksella, lisää sen positiivista osittaista kuormitusta; Ja näin ollen disulfuriinihapolla on vielä voimakkaampi happamuus kuin rikkihapolla.
Voi palvella sinua: kaliumhydroksidi: rakenne, ominaisuudet, käyttötarkoituksetMolekyyli voidaan kirjoittaa h: ksi2Sw4· SW3. Tämä viittaa kuitenkin enemmän oleumin koostumukseen kuin molekyylin rakenteeseen.
Kuitenkin, jos vesimolekyyli lisätään H: ksi2S2JOMPIKUMPI7, Kaksi H -molekyyliä vapautetaan2Sw4-
H2S2JOMPIKUMPI7 + H2Tai 2h2Sw4
Tasapaino voi siirtyä vasemmalle: H: n muodostumiseen2S2JOMPIKUMPI7 H: sta2Sw4 Jos lämpöä toimitetaan. Tästä syystä h2S2JOMPIKUMPI7 Se tunnetaan myös nimellä pyrosulfuriinihappo; Koska se voidaan tuottaa rikkihapon lämmityksen jälkeen.
Lisäksi, kuten alussa mainittiin, h2S2JOMPIKUMPI7 Se muodostuu suoralla H: n yhdistelmällä2Sw4 Ja niin3-
Sw3 + H2Sw4 H2S2JOMPIKUMPI7
Ominaisuudet
 Oleum. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta
Oleum. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta Disulfuriinihapon ominaisuudet eivät ole kovin hyvin määriteltyjä, koska on erittäin vaikeaa eristää puhtaasti öljystä.
On muistettava, että öljyssä voi olla muita yhdisteitä, H H: n kanssa2Sw4· Xso3, missä X: n arvosta riippuen voi olla jopa polymeerirakenteita.
Yksi tapa visualisoida se on kuvitella, että H: n ylärakenne2S2JOMPIKUMPI7 tulee enemmän pitkänomaisesti enemmän yksiköitä3 ja happisiltot.
Melkein puhtaassa tilassa se koostuu epävakaasta kiteisestä kiinteästä (tupakoinnista), joka sulaa 36ºC: ssa. Tämä sulamispiste voi kuitenkin vaihdella todellisen koostumuksen mukaan.
Disulfuriinihappo voi muodostaa sen, mitä kutsutaan disulfaatteiksi (tai pyrosulfaatti) -suoloiksi. Esimerkiksi, jos reagoit kaliumhydroksidin kanssa, muodosta kaliumpyrosulfaatti, k2S2JOMPIKUMPI7.
Lisäksi voidaan kommentoida, että sen molekyylipaino on 178 g/mol ja kaksi happoekvivalenttia (2 tunnin ionit+ joka voidaan neutraloida vahvalla emäksellä).
Voi palvella sinua: haihtuvuusSokerin kuivumisreaktio
Tämän öljyn muotoisella yhdisteellä voidaan suorittaa utelias reaktio: hiililohkojen muuntaminen.
H2S2JOMPIKUMPI7 Se reagoi sokerien kanssa, jotka eliminoivat kaikki OH -ryhmänsä veden muodossa, mikä suosii uusia ammattiliittoja hiiliatomien keskuudessa; ammattiliitot, jotka lopulta aiheuttavat mustaa hiiltä.
Nimikkeistö
Disulfuriinihappoa pidetään rikkihapon anhydridinä; Eli se menettää vesimolekyylin kondensaatiotuotteen kahden happamolekyylin välillä. Ennen niin monia mahdollisia nimiä tälle yhdisteelle IUPAC -nimikkeistö suosittelee vain disulfuriinihappoa.
Termi 'piro' viittaa yksinomaan siihen, joka muodostuu lämmönsovelluksen tuotteesta. IUPAC ei suosittele tätä nimeä H: lle2S2JOMPIKUMPI7; Mutta sitä käytetään edelleen monet kemistit.
ICO -ico pysyy muuttumattomana, koska rikkitomi jatkaa valenssin ylläpitämistä +6. Esimerkiksi se voidaan laskea seuraavalla aritmeettisella toiminnalla:
2H + 2s + 7o = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Sovellukset
Varastoi rikkihappoa
Disulfuriinihappo, koska sen ominaisuus kiinteyttää öljynä, kykenee liuottamaan ja varastoimaan turvallisemmin rikkihappoa. Tämä johtuu siitä3 pakenee luomalla epäilyttämätön "sumu", joka on paljon liukoisempi H: ssä2Sw4 kuin vedessä. H: n hankkimiseksi2Sw4, Riittää lisäämään vesiöljyä:
H2S2JOMPIKUMPI7 + H2Tai 2h2Sw4
100% rikkihapon synteesi
Edellisestä yhtälöstä H2Sw4 Se laimennetaan lisättyyn veteen. Esimerkiksi, jos sinulla on vesiliuos H2Sw4, Missä niin3 Se pyrkii pakenemaan ja edustaa työntekijöiden riskiä, lisäämällä öljyä liuokseen. Tämä reagoi veden muodostaen enemmän rikkihappoa; toisin sanoen sen pitoisuuden lisääminen.
Se voi palvella sinua: kemiallinen läpäisemätönJos vettä on jäljellä, enemmän on lisätty3, joka reagoi H: n kanssa2Sw4 tuottaa enemmän disulfuriinihappoa tai öljyä, ja sitten se hydratoi uudelleen "kuivumaan" H: n2Sw4. Prosessi toistaa toisinaan riittävän rikkihappoa 100 -prosenttisessa konsentraatiossa.
Samankaltaista prosessia käytetään 100% typpihapon saamiseksi. Samoin sitä on käytetty muiden kemiallisten aineiden kuivumiseen, jota käytetään räjähtävään kehittämiseen.
Sulfonaatio
Rakenteet, kuten väriaineet; eli lisää ryhmiä3H, mikä happaman protonin menettäminen voidaan ankkuroida tekstiilikuitupolymeeriin.
Toisaalta oleumin happamuutta käytetään toisen nitraation saavuttamiseen (lisää ryhmät -NO2) aromaattisiin renkaiihin.
Viitteet
- Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Pyrosulfuriinihappo. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- « 20 Renessanssin keksintöä, jotka muuttivat maailmaa
- Bakteerien levitys mikä on, ominaisuudet ja valmisteet »

