Typpihappo (HNO3)
- 2645
- 671
- Joshua Emmerich
Hän typpihappo Se on epäorgaaninen yhdiste, joka koostuu typen oksoasidista. Sitä pidetään vahvana happona, vaikka sen PKA (-1,4) on samanlainen kuin hydroniumionin PKA (-1,74). Tästä hetkestä lähtien se on ehkä "heikoin" monista tunnetuista vahvoista hapoista.
Sen fyysinen ulkonäkö koostuu värittömästä nesteestä, joka varastointia muuttuu kellertäväksi typpikaasujen muodostumisen vuoksi. Sen kemiallinen kaava on hno3.
Se on epävakaa, jolla on kevyt hajoaminen auringonvalolle altistumiseen. Lisäksi se voidaan hajottaa kokonaan kuumentamalla, aiheuttaen typpi-, vesi- ja happidioksidia.
Sitä käytetään epäorgaanisten ja orgaanisten nitraattien valmistuksessa, samoin kuin typpipitoisissa yhdisteissä, joita käytetään lannoitteiden, räjähteiden, väriaineiden välittäjien ja erilaisten orgaanisten kemiallisten yhdisteiden valmistuksessa.
Ilmakehässä ei2 Ihmisen aktiivisuuden tuottama reagoi pilvien veden kanssa muodostaen HNO: n3. Sitten happojen sateiden aikana saostuu yhdessä vesipisaran syömisen kanssa, esimerkiksi julkisten neliöiden patsaat.
Typpihappo on erittäin myrkyllinen yhdiste, ja jatkuva altistuminen sen höyryille voi tuottaa kroonista keuhkoputkentulehdusta ja kemiallista keuhkokuumetta.
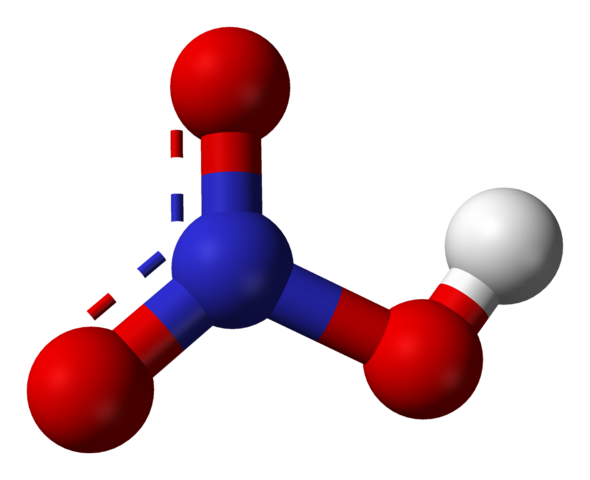
Typpihapporakenne
 Lähde: Ben Mills [julkinen alue], Wikimedia Commons
Lähde: Ben Mills [julkinen alue], Wikimedia Commons Yläkuva näyttää HNO -molekyylin rakenteen3 Palloilla ja baarimallilla. Typpiatomi, sininen pallo, sijaitsee keskustassa, jota ympäröi trigonaalinen tasainen geometria; Kolmio on kuitenkin vääristynyt yksi sen pisin kärki.
Typpihappomolekyylit ovat sitten tasaisia. Linkit n = o, n-o ja n-oh muodostavat tasaisen kolmion kärkipisteet. Jos N-OH-linkki havaitaan yksityiskohtaisesti, se on pitkänomainen kuin kaksi muuta (missä valkoinen pallo edustaa H-atomia).
Resonanssirakenteet
On olemassa kaksi linkkiä, joilla on sama pituus: n = o ja n-o. Tämä tosiasia on vastoin Valencian linkkiteoriaa, jossa ennustetaan, että kaksoislinkit ovat lyhyempiä kuin yksinkertaiset linkit. Selitys tässä on resonanssin ilmiö, kuten alemmassa kuvassa havaitaan.
 Lähde: Ben Mills [julkinen alue], Wikimedia Commons
Lähde: Ben Mills [julkinen alue], Wikimedia Commons Molemmat linkit, n = o ja n-o, ovat siksi vastaavia resonanssitermeissä. Tämä on graafisesti esitetty rakennusmallissa käyttämällä epäjatkuvaa viivaa kahden atomin välillä (katso rakenne).
Kun HNO on suojaamaton3, Vakaa nitraattianioni on muodostettu3-. Siinä resonanssi sisältää nyt kolme atomia tai. Tästä syystä HNO3 Sillä on suuri Bronsted-matala happamuus (hionta-luovuttajalajit+-A.
Voi palvella sinua: Apotettu pipettiFysikaaliset ja kemialliset ominaisuudet
Kemialliset nimet
-Typpihappo
-Atsoottinen happo
-Vetynitraatti
-Fortis -vesi.
Molekyylipaino
63 012 g/mol.
Fyysinen ulkonäkö
Väritön neste tai vaaleankeltainen väri, josta voi tulla punertavanruskea.
Haju
Hehtaarin, ominainen tukahduttava.
Kiehumispiste
181 ºF 760 mmHg (83 ºC).
Sulamispiste
-41,6 ºC.
Vesiliukoisuus
Erittäin liukoinen ja sekoittuva vedellä.
Tiheys
1 513 g/cm3 20 ºC.
Suhteellinen tiheys
1,50 (suhteessa veteen = 1).
Suhteellinen höyrytiheys
2 tai 3 kertaa arvioitu (ilmasuhteessa = 1).
Höyrynpaine
63,1 mmhg 25 ºC: n lämpötilassa.
Hajoaminen
Altistuksella ilmakehän tai lämmön kosteuteen voi hajottaa muodostavan typpiperoksidin. Kun tätä hajoamista lämmitetään, se emittoi typpioksidin ja vetynitraatin erittäin myrkyllisen savun.
Typpihappo ei ole stabiili, se pystyy murtautumaan kosketukseen lämmön ja auringonvalon altistumisen kanssa ja emotihihan dioksidin, hapen ja veden säteilyn.
Goo
1 092 MPa 0 ºC: ssa ja 0,617 MPa 40 ° C: ssa.
Korroosio
Se pystyy hyökkäämään kaikkiin perusmetalleihin, paitsi alumiini ja kromiteräs. Hyökkää joitain muovimateriaalin, kuppien ja pinnoitteiden lajikkeita. Se on kaustinen ja syövyttävä aine, joten sitä on manipuloitava erittäin varovaisesti.
Höyrystymisen molaarinen entalpia
39,1 kJ/mol 25 ºC: lla.
Tavallinen molaarinen entalpia
-207 kJ/mol (298 ºF).
Tavanomainen molaarinen entropia
146 kJ/mol (298 ºF).
Pintajännitys
-0,04356 N/M A 0 ºC
-0,04115 N/M A 20 ºC
-0,0376 N/m 40 ºC
Hajukynnys
-Matala haju: 0,75 mg/m3
-Korkea haju: 250 mg/m3
-Ärsyttävä pitoisuus: 155 mg/m3.
Dissosiaatiovakio
Pka = -1,38.
Taiteindeksi (η/D)
1 393 (16,5 ºC).
Kemialliset reaktiot
Kosteus
Se voi muodostaa kiinteitä hydraatteja, kuten HNO3H2Tai ja hno3∙ 3H2O: "Typpinen jää".
Dissosiaatio vedessä
Typpihappo on vahva happo, joka ionisoi nopeasti vedessä seuraavalla tavalla:
Hno3 (L) +h2Tai (l) => h3JOMPIKUMPI+ (ac) +ei3-
Myynnin muodostuminen
Reagoi nitraatin ja vesisuolan muodostavien emäksisten oksidien kanssa.
Cao (t) +2 hno3 (l) => ca (ei3-A2 (AC) +H2Tai (l)
Samoin se reagoi emäksien (hydroksidien) kanssa, muodostaen nitraatin ja vesisuolan.
NaOH (AC) +HNO3 (l) => nano3 (AC) +H2Tai (l)
Ja myös karbonaattien ja happamien karbonaattien (bikarbonaattien) kanssa, muodostaen myös hiilidioksidia.
Naa2Yhteistyö3 (AC)+HNO3 (l) => nano3 (AC)+H2Tai (l)+Co2 (g)
Protonaatio
Typpihappo voi myös käyttäytyä emäksenä. Tästä syystä voit reagoida rikkihapon kanssa.
Hno3 + 2H2Sw4 EI2+ + H3JOMPIKUMPI+ + 2Hso4-
Itsekäsittely
Typpihappo kokee itsepropotolyysin.
2HNO3 EI2+ + EI3- + H2JOMPIKUMPI
Metallin hapettuminen
Reaktiossa metallien kanssa typpihappo ei käyttäytyy kuin vahvat hapot, jotka reagoivat metallien kanssa, jotka muodostavat vastaavan suolan ja vapauttaen vedyn kaasumaisella tavalla.
Se voi palvella sinua: hydrokoloidiMagnesium ja mangaani reagoivat kuitenkin kuumana typpihapon kanssa, kuten jäljellä olevat vahvat hapot tekevät.
Mg (s) +2 hno3 (l) => mg (ei3-A2 (AC) +H2 (g)
Toiset
Typpihappo reagoi metallisulfiittien kanssa, jotka aiheuttavat nitraattisuolaa, rikkidioksidia ja vettä.
Naa2Sw3 (s) +2 hno3 (L) => 2 nano3 (AC) +niin2 (g) +h2Tai (l)
Ja reagoi myös orgaanisten yhdisteiden kanssa korvaamalla vety nitroryhmällä; Siten muodostaen perustan räjähtävien yhdisteiden, kuten nitroglyseriinin ja trinitrotolueenin (TNT) synteesille, perusta.
Synteesi
Teollisuus-
Sitä tuotetaan teollisuustasolla ammoniumin katalyyttisen hapettumisen kautta Oswaldin vuonna 1901 kuvaaman menetelmän mukaan vuonna 1901. Menettely koostuu kolmesta vaiheesta tai vaiheesta.
Vaihe 1: Typpioksidin ammoniumin hapettuminen
Ammonium hapettaa ilmassa olevan hapen avulla. Reaktio tehdään 800 ºC: lla ja 6-7 atm: lla, platinaa käyttämällä katalyyttiä. Ammonium sekoitetaan ilman kanssa seuraavalla osuudella: 1 ammoniumtilavuus 8 ilmatilavuudella.
4NH3 (g) +5o2 (g) => 4no (g) +6h2Tai (l)
Reaktiosta typpioksidi on peräisin, joka viedään hapetuskammioon seuraavaa vaihetta varten.
Vaihe 2. Typpioksidin hapettuminen typpidioksidissa
Hapetus suoritetaan ilmassa esiintyvällä hapella lämpötilassa alle 100 ºC.
2no (g) +tai2 (g) => 2no2 (g)
Vaihe 3. Typpidioksidin liukeneminen veteen
Tässä vaiheessa typpihappojen muodostuminen tapahtuu.
42 + 2H2Tai +o2 => 4HNO3
Typpidioksidin imeytymiseen on useita menetelmiä (ei2) Vedessä.
Muiden menetelmien joukossa: ei2 on dimeroitu N: lle2JOMPIKUMPI4 alhaisissa lämpötiloissa ja korkeassa paineessa sen lisäämiseksi veden liukoisuuden lisäämiseksi ja typpihappojen tuottamiseksi.
3N2JOMPIKUMPI4 + 2H2O => 4HNO3 + 2
Ammoniumhapetuksella tuotetulla typpihapolla on pitoisuus välillä 50-70%, jonka voidaan ottaa 98%: iin käyttämällä rikkihappoa, joka on konsentroitu kuivumisena, mikä mahdollistaa typpihappopitoisuuden lisäämisen.
Laboratoriossa
Kuparinitraatin (II) lämpöhajoaminen, tuottaen typpi- ja happidioksidikaasuja, jotka johdetaan veden läpi typpihapon muodostamiseksi; Kuten aiemmin kuvattu Oswald -menetelmässä.
2CU (ei3-A2 => 2cuo +4no2 + JOMPIKUMPI2
Nitraattisuolan reaktio H: n kanssa2Sw4 keskitetty. Muodostettu typpihappo on erotettu H: stä2Sw4 tislaamalla 83 ºC: ssa (typpihappo kiehumispiste).
Voi palvella sinua: valmistunut pipetti: Ominaisuudet ja käytötKno3 + H2Sw4 => Hno3 + Khso4
Sovellukset
- 60% typpihapon tuotannosta käytetään lannoitteiden, erityisesti ammoniumnitraatin valmistuksessa.
- 15 % typpihappotuotannosta käytetään synteettisessä kuidun valmistuksessa.
- Sitä käytetään typpin ja nitroderivisoitujen happoesterien kehittämisessä; kuten nitroselluloosa, akryylimaalaukset, nitrobentseeni, nitrotolueeni, acrilonitrilos jne.
- Voit lisätä nitroryhmiä orgaanisiin yhdisteisiin, kyvyn käyttää tätä ominaisuutta räjähteiden, kuten nitroglyseriinin ja trinitrotolueenin (TNT) valmistamiseen.
- Hapetuskyvyn vuoksi se on erittäin hyödyllinen mineraaleissa olevien metallien puhdistamisessa. Sitä käytetään myös elementtien, kuten uraanin, mangaanin, niobiumin, zirkoniumin, saamiseen ja fosforikivien happamoitumiseen fosforihapon saamiseksi.
- Se sekoitetaan konsentroituun suolahappoon "kuninkaallisen veden" muodostamiseksi. Tämä liuos pystyy liuottamaan kultaa ja platinaa, mikä mahdollistaa sen käytön näiden metallien puhdistamisessa.
- Sitä käytetään vanhuusvaikutuksen saamiseen mäntypuusta valmistettuihin huonekaluihin. Käsittely 10-prosenttisella typpihappoliuoksella tuottaa harmaasäiliötä huonekalupuussa.
- Vesipitoisten liuosten seosta, jossa on 5-30% typpihappoa ja fosforihappoa 15-40%, käytetään lypsämisessä käytettyjen laitteiden puhdistamiseen jätteiden poistamiseksi magnesium- ja kalsiumyhdisteiden saostumista.
- Se on hyödyllinen laboratoriossa käytetyn lasimateriaalin puhdistamisessa.
- Liuotinkapasiteetinsa vuoksi sitä käytetään eri metallien analysoinnissa atomien liekin absorptiospektrofotometriatekniikoiden ja induktiivisen kytkentämassan spektrofotometrian avulla.
- Typpihapon ja rikkihapon yhdistelmää käytettiin yleiseen puuvillan muuntamiseen selluloosanitraatiksi (typpisvilla).
- Punaisen tupakoinnin typpihappoa ja valkoista tupakointia typpihappoa käytetään hapettimina rakettien nestemäisille polttoaineille, etenkin Bomarc -ohjuksessa.
Myrkyllisyys
- Kosketuksessa ihon kanssa se voi aiheuttaa ihon palovammoja, voimakasta kipua ja ihottumaa.
- Kosketuksessa silmiin se voi aiheuttaa voimakasta, repiä ja vakavissa tapauksissa sarveiskalvon ja sokeuden vaurioita.
- Höyryjen hengittäminen voi aiheuttaa yskää, hengitysvaikeuksia, aiheuttaen voimakkaita tai kroonisia näyttelyitä, nenäverenvuotoa, lingingiittiä, kroonista keuhkoputkentulehdus, keuhkokuume ja keuhkoödeema.
- Nielemisensä vuoksi vammat tapahtuvat suussa, sylkeessä, voimakkaan janoon, nielemiskipuun, voimakkaasti kipuun koko ruuansulatuksessa ja saman seinämän poraamisriski.
Viitteet
- Typpihappo. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Typpihappo. Encyclopædia britannica. Toipunut: Britannica.com
- Typpihappo. Palautettu: Chemicalbook.com
- « Ideoita, jotka kohtaavat teologisen ajattelun evoluutioteoriaan
- Kuinka vaalit olivat, kun ei ollut itsenäistä ja luotettavaa vaalijärjestelmää? »

