Selenhydric Acid (H2SE) Mikä on, rakenne, ominaisuudet, käyttää
- 2286
- 723
- Arthur Terry II
 Vety seleniuro: kaksi vetymolekyyliä ja yksi seleenistä
Vety seleniuro: kaksi vetymolekyyliä ja yksi seleenistä Mikä on selenhydric -happo?
Hän Selenhydric -happo o vety seleniuro on epäorgaaninen yhdiste, jonka kemiallinen kaava on H2HÄN. Se on luonteeltaan kovalenttinen, ja tavallisissa lämpötiloissa ja paineolosuhteissa se on väritön kaasu; Mutta voimakkaasti tunnistettava haju sen vähäisestä läsnäolosta. Kemiallisesti se on traktoiva, joten seleenin Valencia on -2 (i2--A.
Kaikista Seleniurosista, H2Se on myrkyllisin, koska sen molekyyli on pieni ja sen seleeniatomilla on vähemmän steerisiä esteitä reagoidessaan. Toisaalta sen haju antaa sen kanssa työskenteleville, jotka työskentelevät sen havaitsemiseksi laboratoriokellon ulkopuolella.
Vety seleniuro voi syntetisoida sen kahden elementin suoran yhdistelmän avulla: molekyylinen vety, H2, ja metallinen seleeni. Se voidaan saada myös liuottamalla seleeniä runsaasti, kuten raudan seleniuro (II), fese, suolahapossa.
Toisaalta selenhydrinen happo valmistetaan liuottamalla vety Seleniuro veteen; Eli ensimmäinen on liuennut veteen, kun taas toinen koostuu virvoitusjuomista.
Sen pääkäyttö on olla seleenin lähde orgaanisessa ja epäorgaanisessa synteesissä.
Vety seleniuro -rakenne
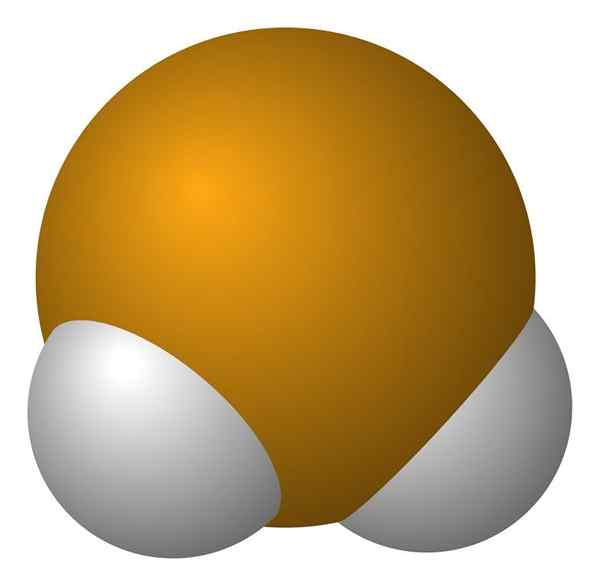
 Vety seleniuro molekyyli. Wikimedia Commons.
Vety seleniuro molekyyli. Wikimedia Commons. H -molekyyli2Se on kulmageometriaa, vaikka sen 91 ° kulma tekee siitä enemmän kuin l kuin v. Tässä pallo- ja tankojen mallissa vetyatomit ja seleeni ovat vastaavasti valkoisia ja keltaisia palloja.
Tämä molekyyli, kuten on esitetty, on se, joka on kaasufaasissa; eli vety Seleniuro. Kun liukenevat veteen, se vapauttaa protonin ja liuoksessa on pari HSE: tä- H3JOMPIKUMPI+; Tämä ionin vääntömomentti tulee Selenhydric -hapolle, joka on merkitty h: ksi2SE (AC) sen erottamiseksi vety Seleniuro, H2Se (g).
Voi palvella sinua: metyleeninsininen: ominaisuudet, valmistelu, käytöt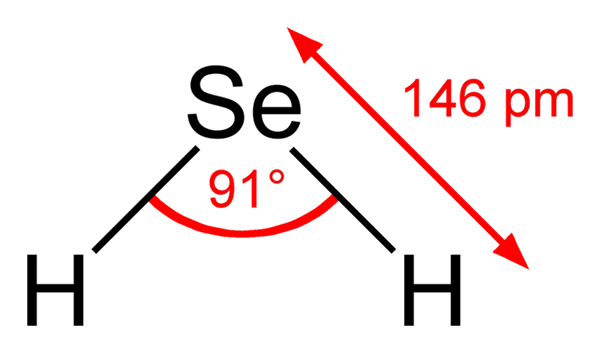 Seleenhydric -hapon rakennekaava. Ben Mills, Wikimedia Commons ..
Seleenhydric -hapon rakennekaava. Ben Mills, Wikimedia Commons .. Siksi H: n väliset rakenteet2SE (AC) ja H2Se (g) ovat hyvin erilaisia; Ensimmäistä ympäröi vesipitoinen pallo ja siinä on ioniset kuormat, ja toinen koostuu kaasufaasimolekyylien agglomeraatista.
H -molekyylit2He voivat tuskin olla vuorovaikutuksessa toistensa kanssa erittäin heikkojen voimien kautta Dipolo-Dipolon. Seleeni, vaikka se on vähemmän elektronegatiivinen kuin rikkipitoisuudet suurempi elektroninen tiheys "sieppaamaan" vetyatomeista.
Selenio Hydres Pacpressed
Jos H -molekyylejä2Ne läpikäyvät poikkeuksellisen painetta (satoja GPA), teoreettisesti ne pakotetaan kiinteytymään muodostamalla SE-H-SE-linkit; Nämä ovat linkkejä kolmesta keskuksesta ja kahdesta elektronista (3c-2e), joihin vety osallistuu. Siksi molekyylit alkavat muodostaa polymeerirakenteita, jotka määrittelevät kiinteän osan.
Näissä olosuhteissa voidaan rikastuttaa kiinteää vetyä, mikä muuttaa tuloksena olevia rakenteita kokonaan. Lisäksi koostumuksesta tulee tyyppi HnSE, missä n vaihtelee 3 - 6. Siten näiden paineiden puristettuja seleenihydridejä ja vedyn läsnä ollessa kemiallisia kaavoja H3Tiedän h6HÄN.
Arvioidaan, että näillä vety rikastetuilla seleenihydroreilla on superhallinnollisia ominaisuuksia.
Ominaisuudet
Fyysinen ulkonäkö
Väritön kaasu, joka alhaisissa lämpötiloissa haisee putrefacto- ja mätät munat, jos sen pitoisuus kasvaa. Sen haju on huonompi ja voimakkaampi kuin rikkivety (joka on jo melko epämiellyttävä). Tämä on kuitenkin hyvä, koska se auttaa sen helppoa havaitsemista ja vähentää pitkittyneitä kosketus- tai hengitysriskejä.
Kun se palaa, se antaa sinertävän liekkituotteen elektronisista vuorovaikutuksista seleeniatomeissa.
Voi palvella sinua: RikkioksidiMolekyylimassa
80,98 g/mol.
Kiehumispiste
-41 ° C.
Sulamispiste
-66 ° C.
Höyrynpaine
9,5 atm 21 ° C: ssa.
Tiheys
3 553 g/l.
Pk-lla
3.89.
Vesiliukoisuus
0,70 g/100 ml. Tämä vahvistaa tosiasian, että H: n seleeniatomi2Et voi muodostaa vety silloja, jotka ovat tuntuvia vesimolekyyleillä.
Liukoisuus muihin liuottimiin
-Liukoinen CS: ssä2, Mikä ei ole yllättävää seleenin ja rikin välisestä kemiallisesta analogiasta.
-Fosgen liukoinen (alhaisissa lämpötiloissa, koska se kiehuu 8 ° C: ssa).
Nimikkeistö
Kuten aiemmissa osioissa selitetään, tämän yhdisteen nimi vaihtelee riippuen siitä, onko h2Se on soodassa tai liuenneen faasin vedessä. Kun se on vedessä, puhuu seleenhydric -haposta, mikä ei ole muuta kuin hydratia epäorgaanisesti. Toisin kuin kaasumolekyylit, sen happama luonne on suurempi.
Kuitenkin joko kaasuna tai liuenneena veteen, seleeniatomilla on kuitenkin samat elektroniset ominaisuudet; Esimerkiksi sen Valencia on -2, ellet kärsi hapetusreaktiosta. Tämä Valencia -2 on syy siihen, miksi sitä kutsutaan Seleniaurochit vety, koska Seleniuro -anionin on2-; joka on reaktiivisempi ja pelkistimen kuin S2-, sulfidi.
Jos käytetään systemaattista nimikkeistöä, yhdisteessä olevien vetyatomien lukumäärä on määritettävä. Siten h2Sitä kutsutaan: seleniuro antaavety.
Seleniuro tai hydridi?
Jotkut lähteet viittaavat häneen hydridiksi. Jos se todella olisi, seleenillä olisi positiivinen varaus +2 ja vety -negatiivinen kuorma -1: SEH2 (HÄN2+, H--A. Seleeni on elektronegatiivisempi atomi kuin vety, ja siksi päättyy "monopolisoinnin" korkeimman elektronisen tiheyden H -molekyylissä2HÄN.
Voi palvella sinua: ThermokemiaSellaisenaan seleenihydridin olemassaoloa ei kuitenkaan voida hylätä. Itse asiassa H -anionien läsnäololla- Se helpottaisi SE-H-SE-linkkejä, jotka vastaavat kiinteistä rakenteista, jotka on muodostettu valtaviin paineisiin tietokoneopintojen mukaan.
Sovellukset
Aineenvaihdunta-
Vaikka se vaikuttaa ristiriitaiselta, H: n suuresta myrkyllisyydestä huolimatta2SE, se tuotetaan kehossa seleenin metabolisella reitillä. Soluja tuotetaan kuitenkin tuskin välittäjänä selenioproteiinien syntiumissa tai päätyy metyloituneiksi ja erittyneiksi; Yksi tämän oireista on valkosipulin maku suussa.
Teollisuuden edustajat
H2Sitä käytetään pääasiassa seleeniatomien lisäämiseen kiinteisiin rakenteisiin, kuten puolijohdemateriaaleihin; orgaanisille molekyyleille, kuten alkeenille ja nitrileille orgaanisten seleniurosten synteesiä varten; tai liuokseen metallisten seleniurosten saostamiseksi.
Viitteet
- Vety selenidi. Haettu: vuonna.Wikipedia.org
- Vety selenidi, h2HÄN. Toipunut: seleeni.Atomisti.com

