Sulfaniilihapon rakenne, ominaisuudet, synteesi, käyttää
- 3565
- 22
- Gabriel Fahey
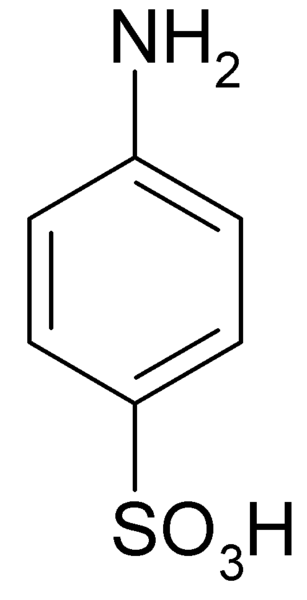
Hän Sulfaniilihappo Se on kiteinen yhdiste, jonka molekyyli muodostuu bentseenirenkaasta, johon emäksinen ryhmä on samanaikaisesti yhdistynyt (-NH2) ja happoryhmä (-niin3H). Sen kemiallinen kaava on NH2C6H4Sw3H.
Se tunnetaan myös nimellä 4-aminobencenosulfonihappo. Se valmistetaan aniliinin sulfonoinnilla asennossa. Hänen kiteensä ovat valkoisia tai valkoisia. Sen käyttäytyminen on samanlainen kuin suola kuin orgaaninen yhdiste NH -ryhmien kanssa2 karhu3H. Siksi se on liukenematon useimmissa orgaanisissa liuottimissa.
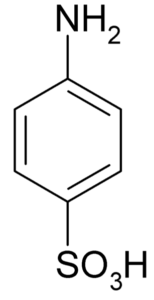 Sulfaniilihapon tai 4-amynobenzeulfonihapon molekyylinen kaava. Klaus Hoffmeier [julkinen alue]. Lähde: Wikipedia kuin meistä
Sulfaniilihapon tai 4-amynobenzeulfonihapon molekyylinen kaava. Klaus Hoffmeier [julkinen alue]. Lähde: Wikipedia kuin meistä Yksi sen pääkäytöistä on väriaineiden synteesissä, koska se muodostaa helposti diazokotedin, joka on raaka -ainetta kyseiselle sovellukselle.
Sekä sulfanyylihappoa että sen johdannaisia on käytetty antibakteerisina aineina. Sitä käytetään mucolyyttisten yhdisteiden synteesissä, koska niillä on kyky vähentää liman viskositeettia tai hyvin viskoosisia biologisia nesteitä.
Sitä käytetään myös paperiteollisuudessa ja kaiverrusten tai litografien kaavoissa. Se on osa hartseja, joita käytetään betoniseoksissa tai laastiin, jotta he voivat säilyttää sujuvuutensa pitkään, vaikuttamatta lopulliseen asetusaikaan.
Se on ksenobioottinen metaboliitti, tämä tarkoittaa, että elävät olennot eivät luonnollisesti tuota sitä. Se on ärsyttävää ihoa, silmiä ja limakalvoja. Lisäksi voit saastuttaa ympäristön.
[TOC]
Rakenne
Sulfaniilihapolla on valkoisia kiteitä, jotka on muodostettu ortorromisilla tai monokliinisillä arkeilla. Sen monohydraatti kiteytyy vedessä ortorromisten arkkien muodossa. Jos kiteytyminen tehdään hyvin hitaasti, kiteyttää dihydraatin. Monohydraatti muuttuu vedettömästi, kun se on noin 100 ºC.
Nimikkeistö
- Sulfaniilihappo.
- P-amynobencenosulfonihappo.
- 4-amybonzefonihappo.
Ominaisuudet
Fyysinen tila
Valkoinen tai valkoinen kiteinen kiinteä.
Molekyylipaino
173,19 g/mol.
Sulamispiste
Se hajoaa noin 288 ºC: seen sulattamatta. Sen ilmoitetaan myös> 320 ºC.
Tiheys
1,49 g/cm3
Liukoisuus
Lähes liukenematon veteen: 10,68 g/l 20 ºC: n lämpötilassa.
Liukenematon etanoliin, bentseeniin ja eetteriin. Liukenee hieman kuumaan metanoliin.
Liukoinen vesiliuoksissa. Liukenematon vesihapon liuoksiin. Liukoinen väkevöityyn suolahappoon.
Kemialliset ominaisuudet
Sen ominaisuudet eroavat muiden amiinin tai sulfonoitujen yhdisteiden ominaisuuksista, jotka ovat samanlaisia kuin suolan ominaisuudet. Tämä johtuu siitä, että sen rakenne sisältää ryhmät -nh3+ Ja niin3-, Mikä antaa sille dipoli -ionin ominaisuudet.
Voi palvella sinua: ylikyllästetyt ratkaisutSe sisältää happaryhmän ja emäksisen ryhmän saman molekyylin vastakkaisissa napoissa. Mutta vety -ioni on kytketty typeen hapen sijasta, koska ryhmä -NH2 Se on vahvempi pohja kuin ryhmä -niin3-.
Koska se on dipoli -ioni, on korkea sulautumisen ja liukenemattomuuden kohda.
Sulfaniilihappo on liukoinen alkaliseen liuokseen, koska OH -hydroksidi -ioni-, Koska vety -ioni on voimakkaasti emäksinen (h (H+) heikko perusryhmä -NH2, P-aminobencenosulfonaatti-ionin muodostaminen, joka on vesiliukoinen.
Happoliuoksessa sulfanyylihapporakenne ei muutu, joten se pysyy liukenemattomana.
Muut ominaisuudet
Hänen hajoamiseensa kuumennettu.
Sulfanyylihappoaltistuminen voi johtaa oireisiin, kuten ihon ärsytys, silmät ja limakalvot. Se on syövyttävä yhdiste.
Synteesi
Se valmistetaan reagoimalla aniliinia rikkihapon kanssa (H2Sw4) korkeissa lämpötiloissa. Alun perin muodostuu aniliiniassisuola suola, joka kuumennettaessa 180-200 ºC: ssa järjestetään uudelleen, jotta rengas korvataan paikoilleen, koska se on vakain tuote.
Sen valmistamiseksi suurella puhtaudella aniliinin ja sulfolano -seoksen sulfonaatio suoritetaan H: llä2Sw4 klo 180-190 ºC.
Sovellukset
Väritysteollisuudessa
Sulfanyylihappoa käytetään useiden väriaineiden, kuten metyylioranssin ja tartratsiinin, synteesissä tai valmistuksessa. Tätä varten se on diatsotisoitu, tuottaen diatsotisoidun sulfanyylihapon.
On tärkeää korostaa, että tartratsiinia on käytetty värinä ruoassa. Mutta kun se on nautittu, se tuottaa tiettyjä metaboliitteja ihmisen organismissa, mukaan lukien sulfanyylihappo, jotka ovat mahdollisia reaktiivisten happilajien muodostumisesta. Ne voivat vaikuttaa munuaisten (munuaisten) tai maksankudoksiin (maksa).
 Karamellit, joissa on keltainen väriaine. David Adam Kess [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons
Karamellit, joissa on keltainen väriaine. David Adam Kess [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons Analyyttisessä kemiassa
Sitä käytetään reagenssina useiden kemiallisten yhdisteiden, mukaan lukien nitriitit, määrittämisessä.
Lääketieteessä antibakteerisena aineena
Sulfanyylihaposta johdettu sulfanyyliamidi on käyttö lääketeollisuudessa, koska sillä on antibakteerinen aktiivisuus.
Ihmiskehossa bakteerit sekoittavat sen p-aminobentsoehappoon, joka on välttämätön metaboliitti. Tämä substituutio aiheuttaa bakteereja, joita ei voida toistaa ja kuolee.
Voi palvella sinua: vety: historia, rakenne, ominaisuudet ja käytöt Bakteeri. Raman Oza -kuva. Lähde: Pixabay
Bakteeri. Raman Oza -kuva. Lähde: Pixabay Toisella sulfanyylihaposta johdetulla, joka on saatu kondensaatiolla muiden yhdisteiden kanssa, on myös antibakteerisia ominaisuuksia, jotka perustuvat sen kykyyn syrjäyttää foolihappo (B -vitamiinikompleksin jäsen).
Tätä yhdistettä voidaan ottaa suun kautta, injektoida laskimonsisäisesti tai levittää ulkoisesti voiteeseen.
Lääketieteessä mucolyyttisenä aineena
Sulfanyylihappojohdannaista, jolla on mucolyyttinen aktiivisuus. Tämä on, että se esittelee licueFactiva -limakehityksen, liman tai hyvin viskoosisten biologisten nesteiden liuottamiseksi.
Yhdistettä voidaan käyttää kudoksen tuottaman liman tuottamiseen patologisten olosuhteiden vuoksi. Esimerkiksi hengityselinten tai emättimen traktaatin ruuhkat, muun muassa.
Kun kyse on liman nesteytyksestä hengitysteissä, tuote annetaan hengittämällä, putoaa nenään, kasteen, aerosoliin tai sumuttimiin. Se on ihmisille tai nisäkkäisiin sovellettava hoito. Se on tehokkaampi yhdiste kuin kysteiinipohjainen.
 Nasaalipisaroiden käyttö kylmälle. Thorsten Frenzel -kuva. Lähde: Pixabay
Nasaalipisaroiden käyttö kylmälle. Thorsten Frenzel -kuva. Lähde: Pixabay Sitä käytetään myös laboratoriossa, kun halutaan vähentää biologisten nesteiden viskositeettia analyyttisten määritysten helpottamiseksi.
Bioanalyysilaboratorioissa
Bilirubiinin määrittämisessä käytetään diatsotisoitua sulfanyylihappoa (johdannainen, joka valmistetaan reagoimalla sulfanyylihappoa natriumnitriitin kanssa).
Bilirubiini on keltainen pigmentti, jota löytyy sappista. Veren bilirubiinin ylimäärä on seuraus maksasairauksista, hematologisista häiriöistä (tai verestä) tai sappiruoan häiriöistä.
Veren bilirubiinin määrän mittaamiseksi bilirubiinin sulfanyylihapoista johdettu dialyysi reagoitiin atsobilirubiinikompleksin muodostamiseksi, jonka väriä mitataan intensiteetin kanssa kolorimetrillä tai spektrofotometrillä. Tällä tavoin veri bilirubiinipitoisuus määritetään veressä.
Paperiteollisuudessa
Sulfaniilihappo antaa sinun syntetisoida paperin kiillotuksen, toisin sanoen yhdiste, joka tarjoaa optisen kirkkauden tai valkoisen ulkonäön, koska neutraloivat luonnollisen tai jäljittämättömän paperin keltaisen värin.
 Valkoinen paperi -tietokone. Lähde: Pexels
Valkoinen paperi -tietokone. Lähde: Pexels Sillä on etu muihin yhdisteisiin nähden, koska sitä voidaan käyttää suhteellisen korkeissa pitoisuuksissa paperimassan käsittelemiseksi alhaisissa pH -olosuhteissa, lisäämättä paperia keltaista.
Voi palvella sinua: ammoniumsulfaattiTulos käy ilmi, kun paperia havaitaan UV -valolla (ultravioletti), jonka alla fluoresoi paljon enemmän kuin silloin, kun muita yhdisteitä käytetään, ja näkyvällä valolla havaitaan, että kellertavuusaste on hyvin matala.
Se on hyvin liukoinen veteen, jolloin se voi käyttää tiivistetyissä liuoksissa. Sitä voidaan käyttää minkä tahansa tyyppisissä paperissa, mukaan lukien jauhetulla puumassassa, sulfite massassa tai millä tahansa muulla prosessilla tuotettua paperia.
Vaikutelmissa kaiverrukset tai litografia
Sulfaniilihappo toimii happamana konsentroituneissa liuoksissa litografialle esittämättä muiden happojen, kuten fosforia.
Rakennusmateriaaleissa
Sulfanyylihapolla modifioidut vesipitoiset melamiini-formaldehydihartsiliuokset on testattu spesifisesti (betoni), laasti tai sementtipasta. Tarkoituksena on ollut vähentää vesipitoisuutta ja estää seoksen juoksevuuden väheneminen ajan kuluessa, ilman asetusaikaa vähenevät.
Näillä liuoksilla valmistettu betoni tai laasti on erittäin tehokas kesällä, kun sujuvuuden väheneminen ajan myötä muodostaa ongelman.
Jos näiden liuosten avulla valmistetaan laasti tai betoni ja jostain syystä sen on annettava levätä, sementtikoostumus voidaan helposti purkaa muotteihin tai vastaaviin, koska se ei ole menettänyt sujuvuutta ajan myötä.
 Konkreettinen purkaus. Igor -kuva ovSyannykov. Lähde: Pixabay
Konkreettinen purkaus. Igor -kuva ovSyannykov. Lähde: Pixabay Viitteet
- Windholz, m. et al. (Toimittajat) (1983). Merck -indeksi. Kemikaalien, drarugien ja biologisten aineiden tietosanakirja. Kymmenes painos. Merck & Co., Inc.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Nide 2. Neljäs painos. John Wiley & Sons.
- Lääketieteen kansalliskirjasto. (2019). Sulfaniilihappo. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Uristi, h. ja Martin, G.J -. (1950). Sulfaniilihappojohdannaiset. Yhdysvaltain patentti ei. 2 504 471. Nimeäjät kansalliselle lääkeyhtiölle. 18. huhtikuuta 1950.
- Huvila, Frederick G. (1964). Metaniili- ja sulfaniilihaposta derced -paperikoostumus paperille. Yhdysvaltain patentti ei. 3,132 106. 5. toukokuuta 1964.
- Martin, Tellis a. ja syö, William T. (1979). Bentsoehappojohdannainen ja bentseenisulfonihappojen limakalvoprosessi. Yhdysvaltain patentti ei. 4 132 802. 2. tammikuuta 1979.
- Druker, L.J -. ja Kincaid, R.B -. (1979). Litografinen suihkulähde konsentraatti. Yhdysvaltain patentti ei. 4 150 996. 24. huhtikuuta 1979.
- Shull, Bruce C. (1983). Bilirubin -määritys. Yhdysvaltain patentti ei. 4 404 286. 13. syyskuuta 1983.
- Uchida, J. et al. (2001). Prosessi sulfaniilihappojen modifioidun melamiini-formaldehydihartsin ja sementtikoostumuksen vesiliuoksen valmistelemiseksi. Yhdysvaltain patentti ei. 6 214,965 B1. 10. huhtikuuta 2001.
- Corradini, M.G. (2019). Osa 1. Elintarvikekemian tietosanakirjassa. ScienEdirect.com.
- « Galiinihapporakenne, ominaisuudet, hankkiminen, käyttää
- Musta taustalla, kehityksellä, toimenpiteillä »

