Yodhydric Acid (HI) -rakenne, ominaisuudet ja käytöt

- 4860
- 1067
- Edgar VonRueden
Hän iarhydric -happo Se on vetyjodidin vesiliuos, jolle on ominaista sen korkea happamuus. Määritelmä, joka on kiinnitetty enemmän kemialliseen terminologiaan ja IUPAC: hen, on, että se on hydratia, jonka kemiallinen kaava on HI.
Sen erottamiseksi vetyjodidin kaasumaisista molekyyleistä, HI (g), se merkitään nimellä HI (AC). Tästä syystä kemiallisissa yhtälöissä on tärkeää tunnistaa ympäristö tai fysikaalinen vaihe, jossa reagenssit ja tuotteet ovat olleet. Silti sekaannukset vedyn jodidin ja iarchloriinihapon välillä ovat yleensä yleisiä.
 Iarhydric -happo -ionit. Lähde: Gabriel Bolívar.
Iarhydric -happo -ionit. Lähde: Gabriel Bolívar. Jos sitoutuneita molekyylejä havaitaan niiden identiteetissä, löydetään pahamaineiset erot HI (g) ja HI (AC). Hi (g) on H-I-linkki; Hi: ssä (AC) ollessaan todella pari ionia I- ja h3JOMPIKUMPI+ vuorovaikutuksessa oleva sähköstingisesti (ylivoimainen kuva).
Toisaalta HI (AC) on HI (G) -lähde, koska ensimmäinen valmistetaan toisen liukenemisen vedessä. Tästä syystä, ellei se ole kemiallisessa yhtälössä, HI: tä voidaan käyttää myös viittaamaan myös iorydric -happoon. Hi on vahva pelkistävä aine ja erinomainen ionien lähde I- Vesipitoisessa väliaineessa.
[TOC]
Yodhydric -happarakenne
Yodhydric -happo, kuten selitetään, koostuu vedessä Hi -liuoksesta. Vedessä ollessa Hi -molekyylit dissosioituvat kokonaan (vahva elektrolyytti), jotka ovat peräisin ioneista I- ja h3JOMPIKUMPI+. Tämä dissosiaatio voidaan esittää seuraavalla kemiallisella yhtälöllä:
Hei (g) + h2Tai (l) => i-(AC) + H3JOMPIKUMPI+(AC)
Mikä olisi vastaavaa, jos kirjoitetaan seuraavasti:
Hei (g) + h2Tai (l) => HI (AC)
HI (AC) ei kuitenkaan paljasta ollenkaan mitä on tapahtunut kaasumaisille HI -molekyyleille; Se osoittaa vain, että he ovat vesipitoisessa väliaineessa.
Siksi HI (AC): n todellinen rakenne koostuu ioneista I- ja h3JOMPIKUMPI+ Vesimolekyylien ympäröimä kosteuttavat niitä; Mitä tiivistyneempi iarhydric -happo, sitä pienempi vesimolekyylien lukumäärä ilman protonia.
Voi palvella sinua: Boyle LawKaupallisesti, itse asiassa HI -pitoisuus on 48 - 57% vedessä; Konsenttisempi vastaa happoa liian tupakointia (ja vielä vaarallisempi).
Kuvassa voidaan nähdä, että anioni i- Sitä esitetään violetti pallo ja h3JOMPIKUMPI+ Valkoisilla palloilla ja punaisella happiatomilla. Kationi h3JOMPIKUMPI+ Esittelee molekyyligeometriaa trigonaalista pyramidia (kuvan korkeammasta tasosta).
Ominaisuudet
Fyysinen kuvaus
Väritön neste; Mutta voit osoittaa kellertäviä ja ruskeita sävyjä, jos olet suoraan kosketuksessa hapen kanssa. Tämä johtuu siitä, että ionit i- Ne lopulta hapettavat molekyylin jodia, i2. Jos I on paljon2, On enemmän kuin todennäköistä, että triaduro -anionin muodostetaan, i3-, joka värjää liuoksen ruskeana.
Molekyylimassa
127,91 g/mol.
Haju
Hehtaarin.
Tiheys
Tiheys on 1,70 g/ml 57%HI -liuokselle; Koska tiheydet vaihtelevat HI: n eri pitoisuuksien mukaan. Tämä pitoisuus muodostaa azeotrooppisen (se tislataan yhtenä aineena eikä seoksena), jonka suhteellinen stabiilisuus voi olla sen kaupallistaminen muiden ratkaisujen yläpuolella.
Kiehumispiste
57% Hi Azeotrope kiehuu 127ºC: n lämpötilassa 1,03 barin paineessa (siirry ATM: ään).
Pka
-1,78.
Happamuus
Se on erittäin vahva happo, niin paljon, että se on syövyttävä kaikille metalleille ja kudoksille; Jopa kumille.
Tämä johtuu siitä, että H-I-linkki on erittäin heikko ja se on helposti rikki sen vesi-ionisaation aikana. Lisäksi vety sillat I- - Hehe2+ Ne ovat heikkoja, joten ei ole mitään häiritä H: ta3JOMPIKUMPI+ reagoi muiden yhdisteiden kanssa; eli H3JOMPIKUMPI+ on "ilmainen", kuten minä- Se ei houkuttele liikaa hänen vasta -asemaansa.
Voi palvella sinua: PycnometriVähentävä aine
Hi on voimakas pelkistävä aine, jonka pääreaktiotuote on minä2.
Nimikkeistö
Iarhydric -hapon nimikkeistö johtuu tosiasiasta, että jodi "toimii" yhdellä hapettumistiellä: -1. Ja lisäksi nimi osoittaa, että sillä on vettä rakenteellisessa kaavassa [I-] [H3JOMPIKUMPI+-. Tämä on sen ainoa nimi, koska se ei ole puhdas yhdiste, vaan liuos.
Sovellukset
Jodilähde orgaanisessa ja epäorgaanisessa synteesissä
Hi on erinomainen ionien lähde i- Epäorgaanista ja orgaanista synteesiä varten ja on myös voimakas pelkistävä aine. Esimerkiksi sen 57%: n vesipitoista liukenemista käytetään alkyylijodidien synteesiin (kuten CHO3CH2I) ensisijaisista alkoholista. Samoin OH -ryhmä voi korvata rakenteessa i: n avulla.
Vähentävä aine
Yodhydric -happoa on käytetty vähentämään esimerkiksi hiilihydraatteja. Jos glukoosi liuentuu tähän happoon lämmitetään, se menettää kaikki OH-ryhmänsä, saadaan tuotteena N-heksaanihiilivety.
Samoin sitä on käytetty funktionaalisten grafeenilevyjen ryhmien vähentämiseen, jotta ne voidaan funktionalisoida elektronisille laitteille.
Cativa -prosessi
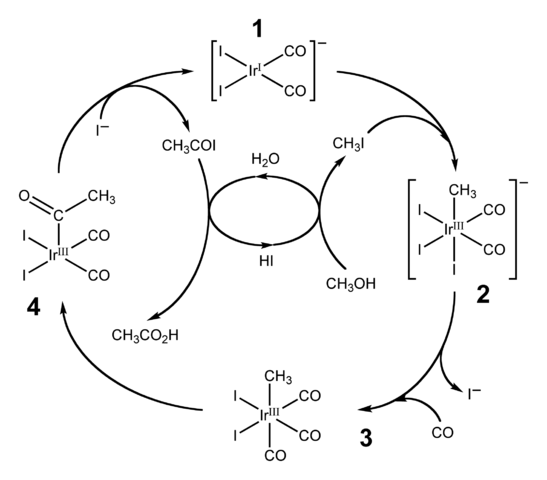 Kaavio katalyyttisestä syklistä Cativa -prosessia varten. Lähde: Ben Mills [julkinen verkkotunnus].HI: tä käytetään myös etikkahapon teollisuustuotantoon Cativa -prosessin kautta. Tämä koostuu katalyyttisestä syklistä, jossa tapahtuu metanolihiilen; eli CH: n molekyyli3Voi karbonyyliryhmä, c = o, muuttumaan cho happoksi3Haittaa.
Kaavio katalyyttisestä syklistä Cativa -prosessia varten. Lähde: Ben Mills [julkinen verkkotunnus].HI: tä käytetään myös etikkahapon teollisuustuotantoon Cativa -prosessin kautta. Tämä koostuu katalyyttisestä syklistä, jossa tapahtuu metanolihiilen; eli CH: n molekyyli3Voi karbonyyliryhmä, c = o, muuttumaan cho happoksi3Haittaa.
Askeleet
Prosessi alkaa (1) Organo-Iridium-kompleksin kanssa [IR (CO)2Yllyttää2--, neliömäinen geometria. Tämä yhdiste "vastaanottaa" metyylijodidin, ch3I, Cho -happamoitumisen tuote3Voi 57% Hei. Vettä esiintyy myös tässä reaktiossa, ja sen ansiosta etikkahappo saadaan lopussa, samalla kun Hi voi palautua viimeisessä vaiheessa.
Voi palvella sinua: kolloidiTässä vaiheessa molemmat ryhmä -CH3 Kun -I liittyy Ididio -metallikeskukseen (2), muodostaen oktaedrisen kompleksin, jonka pinta koostuu kolmesta ligandista ja. Yksi YODO: sta päätyy korvaamaan itsensä hiilimonoksidimolekyylillä, CO; Ja nyt (3), oktaedrikompleksissa on puoli, joka koostuu kolmesta CO -ligandista.
Sitten tapahtuu uudelleenjärjestely: -CH -ryhmä3 Se "vapautetaan" IR: stä ja liittyy viereiseen (4) asetyyliryhmän muodostamiseksi, -coch3. Tämä ryhmä julkaistaan Iridido -kompleksista linkittääkseen jodidi -ioneja ja antamaan Cho3Coi, asetyylijodidi. Täällä Iridium -katalyytti on talteenotettu, valmis osallistumaan toiseen katalyyttiseen sykliin.
Lopuksi, Cho3COI kärsii I: n korvaamisesta- H -molekyylille2Tai jonka mekanismi päättyy vapauttamalla Hi ja etikkahappo.
Laiton synteesi
 Efedriinin pelkistysreaktio punaisella fosforiaalisella ja fosforilla metafetamiiniin. Lähde: metamfetamiini_from_ephedrine_with_hi_ru.SVG: Johdettu RING0 TRABAJO: MaterialScientist (puhuu) [julkinen verkkotunnus].Yodhydric -happoa on käytetty psykotrooppisen aineen synteesiin hyödyntäen sen suurta pelkistävää voimaa. Voit esimerkiksi vähentää efedriiniä (lääketiede astmahoitoon) punaisen fosforin läsnä ollessa metamfetamiiniin (ylivoimainen kuva).
Efedriinin pelkistysreaktio punaisella fosforiaalisella ja fosforilla metafetamiiniin. Lähde: metamfetamiini_from_ephedrine_with_hi_ru.SVG: Johdettu RING0 TRABAJO: MaterialScientist (puhuu) [julkinen verkkotunnus].Yodhydric -happoa on käytetty psykotrooppisen aineen synteesiin hyödyntäen sen suurta pelkistävää voimaa. Voit esimerkiksi vähentää efedriiniä (lääketiede astmahoitoon) punaisen fosforin läsnä ollessa metamfetamiiniin (ylivoimainen kuva).
Voidaan nähdä, että I -ryhmän korvaaminen I: n jälkeen, mitä seuraa toinen korvaaja H: lle.
Viitteet
- Wikipedia. (2019). Hydroiodiinihappo. Haettu: vuonna.Wikipedia.org
- Andrews, Natalie. (24. huhtikuuta 2017). Hydriodihapon käyttö. Tiede. Toipunut: tiedekunnasta.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodihappo. Toipunut: Alfa.com
- Kansallinen bioteknologiatietojen keskus. (2019). Hydriodihappo. Pubchem -tietokanta., CID = 24841. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Steven a. Kovettuja. (2017). Orgaanisen kemian kuvitettu sanasto: Hydroiodiinihappo. Palautettu: Chem.UCLA.Edu
- Reusch William. (5. toukokuuta 2013). Hiilihydraatit. Toipunut: 2.Kemia.MSU.Edu
- Kyu Moonissa, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Uusittu trafeenioksidi kemiallisella grafiitiolla. Doi: 10.1038/NCOMMS1067.
- « Muistorian oppimisominaisuudet, tyypit ja esimerkit
- Bioprosessit ominaisuudet, tyypit, edut ja vaiheet »

