Alumiinikloridi (ALCL3)

- 5005
- 815
- Joshua Emmerich
 Alumiinikloridin kaava ja rakenne
Alumiinikloridin kaava ja rakenne Mikä on alumiinikloridi?
Hän alumiinikloridi Se on epäorgaaninen kemiallinen yhdiste, jonka kaava on ALCL3. Se esitetään kiinteänä tai valkoisena pölynä, vaikka saastumisen vuoksi ferrikloridilla ja kosteudella, se voi tulla keltaiseksi. Se koostuu Lewis -haposta, mutta tietyissä olosuhteissa se käyttäytyy myös Lewis -emäkseksi.
Huolimatta alumiinista metallina jaksollisessa taulukossa, alumiinin ja kloorin välillä on kovalenttinen sidos alumiinikloridin muodostamiseksi.
Tämä kovalenttinen sidos voisi selittää, miksi sulan alumiinikloridi on huono sähkönjohdin; Vaikka muiden yhdisteiden sulat suolat, kuten natriumkloridi, ovat hyviä sähköjohtimia.
Alumiinikloridia tuotetaan eksotermisellä reaktiolla alumiinin ja kloorin tai vetykloridin välillä lämpötilassa välillä 650 - 750 ºC.
Alumiinikloridia käytetään antitranspirantina ja liiallisen hikoilun torjumiseksi. Yhtä sen johdannaista käytetään koagulanttina teollisuuden jäteveden hoidossa, ja sitä käytetään myös pääkatalyyttinä teollisuuden kemiallisissa reaktioissa.
Alumiinikloridirakenne
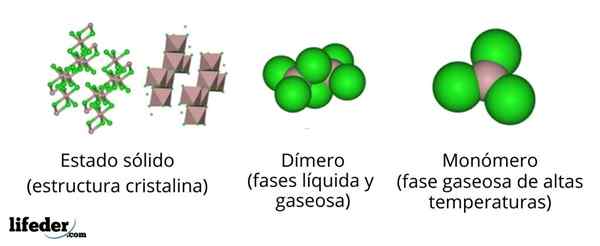
Yläkuvassa meillä on erilaisia esityksiä jokaiselle kiteiselle tai molekyylirakenteelle, jolla on vedettömän alumiinikloridi, ALCL3, Useissa hänen fyysisissä valtioissaan.
Alcl3 Kiinteä kiinteistö koostuu monokliinisestä kiteisestä rakenteesta, joka on muodostettu Octaedros -kerroksilla, jotka on koordinoitu toistensa kanssa. Näissä oktaedrassa (ruskea väri)3+ Se on koordinoitu kuuden Cl -ionin kanssa-, Kloridit sillat kahden oktaedran välillä.
Kun lämpötila nousee ja ALLL perustuu3, Kerrokset on erotettu yksiköiksi2Cl6 (Kuvakeskus). Nyt alumiiniatomi muodostaa yhteydet kolmeen klooriatomiin ja yhteyteen muihin alumiiniatomiin: CL3Al-alcl3. Nämä dimeerit selittävät miksi ALCL3 sula on vähemmän tiheä kuin sen kiteet.
Voi palvella sinua: Gadolinio: rakenne, ominaisuudet, hankkiminen, käyttöHöyryvaiheessa dimeerit2Cl6 He etävät toisiaan. Mutta jos tälle höyrylle kohdistuu korkeita lämpötiloja, dimeeri dissosiaatiota molekyyliyksiköissä ALCL3, jossa alumiiniatomi muodostaa kolme linkkiä klooriatomiin. Alcl3 esittelee trigonaalisen litteän geometrian.
Alumiinikloridiominaisuudet
 Kiinteä näyte alumiinikloridista kellertävien sävyjen kanssa. Lähde: Xlollitox, CC 3: lla.0, Wikimedia Commons
Kiinteä näyte alumiinikloridista kellertävien sävyjen kanssa. Lähde: Xlollitox, CC 3: lla.0, Wikimedia Commons Kaavat
ALCL3 (vedetön)
ALCL3· 6H2O (heksahydraatti)
Moolimassa
133.34 g/mol (anhydro)
241.43 g/mol (heksahydraatti)
Fyysinen ulkonäkö
Kiteinen kiinteä tai valkoinen pöly. Siitä voi tulla kellertävä sävy, joka johtuu saastumisesta ferrikloridilla. Voit myös vaihtaa harmahtavaksi kosteuden värille.
Sulamispiste
192.4 ºC
Kiehumispiste
Sublima 178 ºC: n kohdalla, joten alumiinikloridin kiehumispistettä ei ole helppoa.
Tiheys
2.48 g/cm3 (vedetön)
2.398 g/cm3 (Heksahydraatti)
Vesiliukoisuus
439 g/l A 0 ºC
458 g/l 20 ºC: n lämpötilassa
466 g/l a 30 ºC
Alumiinikloridi on hygroskooppinen yhdiste, joka voi absorboida märkä ilmavettä, säteilemällä savua prosessin aikana.
Liukoisuus muihin liuottimiin
Etanoliliukoinen, kloroformi, hiilitetrakloridi, bentsofenoni ja nitrobentseeni. Liukenee hiukan bentseeniin.
Höyrynpaine
13.3 kPa nopeudella 151 ºC (0.131 ATM).
Goo
0 -.35 CP - 197 ºC
Reaktiivisuus
Alumiinikloridi on amfotaattiaine, ts. Se käyttäytyy kuin happo tai emäs. Sen vaikutusta happona on kuitenkin enempää, koska alumiinikloridia käytetään Lewis -happona ja samalla se on katalyytti monissa kemiallisissa reaktioissa; Heidän joukossaan Friedel-Craftsin reaktio.
Voi palvella sinua: neodyymi: rakenne, ominaisuudet, käytötJopa alumiinikloridi luokitellaan hapoksi sen sijaan, että se tehdään suolana.
Vesipitoisessa liuoksessa olevat vedettömät alumiiniklorid3· 6H2O), joka ei palaa vedettömään muotoon lämmittämällä.
Kahden ALCL -molekyylin alumiiniatomit3 He ovat vuorovaikutuksessa keskenään 8 elektronien suorittamiseksi valenssikerroksessa, mikä johtaa dimeerin muodostumiseen2Cl6. Tätä dimeeriä on läsnä sulaan alumiinikloridissa ja höyryssä.
Alumiinikloridi reagoi natriumhydroksidin kanssa alumiinihydroksidin muodostamiseksi, gelatiininen sakka:
ALCL3 + NaOH → Al (OH)3 + 3 NaCl
Alumiinikloridisovellukset
Antitranspirantti ja antihemorraginen
 Alumiinikloridi on osa useiden deodoranttien formulaatioissa käytettyjä ainesosia. Lähde: Th145, CC BY-Sa 2.0, Wikimedia Commons
Alumiinikloridi on osa useiden deodoranttien formulaatioissa käytettyjä ainesosia. Lähde: Th145, CC BY-Sa 2.0, Wikimedia Commons Alumiinikloridia käytetään henkilökohtaisten deodoranttien torjunta -aineena, ja sitä käytetään myös liiallisen hikoilun hallintaan (hyperhidroosi). Sitä käytetään myös formulaatioissa pienen verenvuodon hallitsemiseksi, kuten hammashoitoissa esitetyt.
Jätevedenpuhdistus
Alumiinikloridia PAC: n muodossa (polyalyalumiinikloridi) käytetään koagulanttina teollisen jäteveden hoidossa johtuen kyvystä selventää vettä ja dehydraattihietettä.
Katalyytti
Alumiinikloridi on yksi teollisuudessa käytetyistä tärkeimmistä katalyytteistä, jotka toimivat katalysaattorina lukuisissa reaktioissa, mukaan lukien Friedel-Crafts.
Voi palvella sinua: europium: rakenne, ominaisuudet, hankkiminen, käyttöAlumiinikloridi katalysoi antraquinonien valmistusreaktioita, joista osa käytetään tekstiiliteollisuudessa. On myös antrakinoneja, joilla on antibakteerisia, antiparasiittisia, siengisidisiä ja viruksenvastaisia ominaisuuksia.
Alumiinikloridi katalysoi Dodecilbentseenin tuottamia reaktioita, joita käytetään pesuaineiden tuotannossa ja etyylibentseenissä, yhdisteessä, jota käytetään polystyreenin valmistuksessa, polymeerissä, jota käytetään muovien, hartsien ja kumin kehittämisessä.
Alumiinikloridia käytetään myös katalyyttinä reaktiossa, joka on osa korkean oktaanialueen bensiinin tuotantoa. Samoin katalysoi öljyn halkeamisprosessia.
Riskejä
Alumiinikloridi on syövyttävä aine ja sen kosketus voi aiheuttaa ärsytystä sekä ihon ja silmävaurioita, mikä aiheuttaa silmävaurioita.
Kun liuentaan veteen, voidaan vapauttaa myrkyllisiä kaasuja, kuten vetykloridia; Kaasut, jotka kykenevät hengittämään nenän ja kurkun ärsytystä, kykenevä aiheuttamaan kovaa ja keuhkojen ärsytystä. Tämä ärsytys voi johtaa nesteen kertymiseen keuhkoihin (keuhkoödeema), joka päättyy lääketieteelliseen hätätilanteeseen.
Se on yrittänyt luoda yhteyden Alzheimerin taudin ja alumiinikloridin välillä; Vaikka tutkimustulokset eivät ole vakuuttavia.
Samoin yhteys deodoranttien käytön välillä, jota he käyttävät anti -transpirantina ALLL: ään, on tutkittu3 ja rintasyöpä. Tutkimus ei ole pystynyt osoittamaan vakuuttavaa suhdetta. Joka tapauksessa alumiinikloridi estää organismin luonnollisen vieroitusjärjestelmän ja lämpöpäästöjen, kuten hiki, toiminnan.
Viitteet
- Wikipedia. (2021). Kloridi -alumiini. Haettu: vuonna.Wikipedia.org
- Kansallinen biotekniikan tietokeskus (2021). Kloridialumiini, Pubchem -yhdisteiden yhteenveto CID 24012: lle. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- NJ Health. (2008). Vaara -aineen tietolomake: Alumiinikloridi. [PDF]. Palautettu: NJ.Hallitus
- Britannica Encyclopaedia. (2021). Kloridi -alumiini. Toipunut: Britannica.com
- Elsevier B.V. (2021). Antrakinonit. Tiede. Haettu: ScienEdirect.com
- John P. Cunha. (02. toukokuuta 2020). Ajankohtainen kloridi -alumiini. Palautettu: rxlist.com

