Strontiumkloridi (SRCL2)
- 2128
- 394
- Mr. Clifford Kshlerin
Mikä on strontiumkloridi?
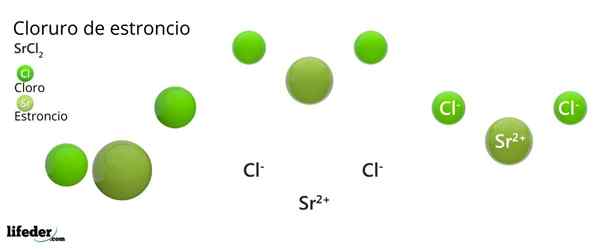
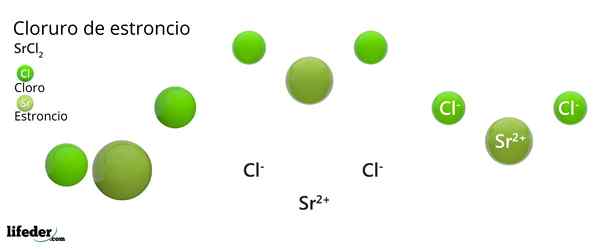
Hän Strontiumkloridi Se on epäorgaaninen yhdiste, jonka on muodostanut strontium, alkalinoterreo -metalli (SR. Becamgbara) ja kloorihalogeeni. Koska molemmilla elementeillä on hyvin erilainen elektronegativiteetti, yhdiste on ioninen kiinteä aine, jonka kemiallinen kaava on SRCL2.
Kuten ioninen kiinteä kiinteä, se koostuu ioneista. SRCL: n tapauksessa2, Ne ovat SR -kationi2+ Jokaisesta kahdesta anionista CL-. Sen ominaisuudet ja sovellukset ovat samanlaisia kuin kalsium- ja bariumkloridi.
Kuten kalsiumkloridi (CACL2), on hygroskooppinen ja sen kiteet absorboivat vettä heksahydraattisuolan muodostamiseksi, jossa kiteisessä hilassa on kuusi vesimolekyyliä (SRCL2· 6H2JOMPIKUMPI). Itse asiassa hydraatin saatavuus on suurempi kuin SRCL2 vedetön (ilman vettä).
Yksi sen tärkeimmistä sovelluksista on edeltäjä muille strontiumyhdisteille; Eli se muodostaa strontiumin lähteen tietyissä kemiallisissa synteesissä.
Strontiumkloridin kemiallinen rakenne
 Strontiumkloridin kiteinen rakenne
Strontiumkloridin kiteinen rakenne Ylivoimainen kuva edustaa SRCL: n muodonmuutos kiteistä rakennetyyppiä2 vedetön. Tässä pienet vihreät pallot vastaavat SR -ioneja2+, Kun taas tilavat vihreät pallot edustavat Cl -ioneja-.
Tässä rakenteessa jokainen SR -ioni2+ Sen "vangitsee" kahdeksan Cl -ionia-, Näin ollen koordinaatioluku on yhtä suuri kuin 8 ja mahdollisesti kuutio geometria sen ympärillä. Eli neljä vihreää palloa tekee kuution katon, kun taas muut neljä lattiaa, SR: n sijaitseva2+ Sen keskellä.
Mikä olisi sooda -faasirakenne? Lewisin rakenne tälle suolalle on CL-SR-CL, ilmeisesti lineaarinen ja olettaen sata prosenttia sen linkeistä. Kuitenkin kaasufaasissa -srcl2(g)- Tämä "linja" näyttää noin 130 ° kulman, tosiasiallisesti eräänlainen V.
Voi palvella sinua: Kaasumainen tila: Ominaisuudet, yleinen laki, esimerkkejäTätä poikkeavuutta ei voitu selittää onnistuneesti, kun otetaan huomioon se, että strontiumilla ei ole jaettuja elektroneja, jotka miehittävät elektronisen tilavuuden. Ehkä se voi johtua kiertoradan D osallistumisesta linkkeihin tai ydinelektronihäiriöihin.
Strontiumkloridin käyttö/sovellukset
SRCL2· 6H2Tai sitä on käytetty lisäaineena orgaanisissa polymeereissä; Esimerkiksi polyvinyylialkoholissa sen mekaanisten ja sähköisten ominaisuuksien modifioimiseksi.
Sitä käytetään strontiumferriitinä keraamisten ja lasimagneetien valmistuksessa television etukiteiden valmistamiseksi.
Reagoi natriumkromaatin kanssa (NA2CRO4) strontiumkromaatin (SRCRO4), jota käytetään korroosiokestävänä maalina alumiinille.
Kun ne lämmitetään tulipalolla, strontiumyhdisteet loistavat punertavan liekin kanssa, minkä vuoksi ne on tarkoitettu soihtojen ja ilotulitteiden laatimiseen.
Lääkehakemus
Strontiumkloridin 89 radioisotooppi (runsain isotooppi on 85Herra.
Laimennettujen liuosten (3-5 %) käyttö yli kahden viikon ajan allergisen nuhan hoidossa (nenän limakalvon krooninen tulehdus) osoittaa parannuksia aivastuksen vähentymisessä ja nenän hankaamisessa.
Kun sitä käytettiin hammaslääketieteellisissä pastaformulaatioissa hammasherkkyyden vähentämiseksi, esteen muodostaminen hammaslääketieteellisille mikrotubuleille.
Tämän yhdisteen tutkimukset osoittavat terapeuttisen tehokkuuden verrattuna prednisoloniin (prednisonilääkemetaboliitti) haavaisen koliitin hoidossa.
Se voi palvella sinua: molaarinen fraktio: miten se lasketaan, esimerkkejä, harjoituksiaSen tulokset perustuvat rottien malliin; Silti se edustaa toivoa niille potilaille, jotka kärsivät myös osteoporoosista, koska he voivat mennä samaan lääkitykseen kahden taudin torjumiseksi.
Sitä käytetään strontiumsulfaatin syntetisointiin (SRSO4), vielä tiheämpi kuin SRCL2. Sen vähimmäisveden liukoisuus ei kuitenkaan tee siitä riittävän kevyttä levitettäväksi radiologiassa, toisin kuin bariumsulfaatti (Baso4-A.
Strontiumkloridin valmistus
Strontiumkloridi voidaan valmistaa suolahapon (HCL) suoran vaikutuksen avulla puhtaaseen metalliin, jolloin esiintyy redox -tyyppireaktiota:
MR (S) + HCl (AC) => SRCL2(AC) + H2(g)
Tässä strontiummetalli hapetetaan luovuttamalla kaksi elektronia kaasumaisen vedyn muodostumisen mahdollistamiseksi.
Myös hydroksidi ja strontiumkarbonaatti (SR (OH)2 ja Srco3) reagoi tämän hapon kanssa syntetisoimalla:
SR (OH)2(S) + 2HCL (AC) => SRCL2(AC) + 2H2Tai (l)
SRCO3(S) + 2HCL (AC) => SRCL2(AC) + Co2(g) + h2Tai (l)
Kiteystekniikoiden soveltaminen SRCL saadaan2· 6H2JOMPIKUMPI. Lämpötoimenpiteellä kuivumisen jälkeen, kunnes SRCL lopulta tuottaa2 vedetön.
Strontiumkloridiominaisuudet
Tämän yhdisteen fysikaaliset ja kemialliset ominaisuudet riippuvat siitä, onko se sen hydratoitu vai vedettömässä muodossa. Tämä johtuu siitä, että sähköstaattiset vuorovaikutukset muuttuvat, kun vesimolekyylit lisätään SRCL: n kiteiseen hilaan2.
Vedetön
Strontiumkloridi on valkoinen kiteinen kiinteä aine, jonka molekyylipaino on 158,53 g/mol ja tiheys 3,05 g/ml.
Sen sulamispisteet (874 ºC) ja kiehuminen (1250 ºC) ovat korkeat, mikä osoittaa SR -ionien voimakasta sähköstaattista vuorovaikutusta2+ ja cl-. Se heijastaa myös suurta kiteistä retikulaarista energiaa, joka sen vedettömällä rakenteella on.
Voi palvella sinua: selluloosa -asetaattiSRCL: n muodostumisen entalpia2 Kiinteä on 828,85 kJ/mol. Tämä viittaa kunkin komponenteista muodostettujen moolien vapauttamaan lämpöenergiaan standarditiloissaan: kloori ja kiinteä kaasu strontiumille.
Heksahydraatti
Heksahydraatin muodossa sillä on korkeampi molekyylipaino kuin sen vedettömän (267 g/mol) muoto ja alempi tiheys (1,96 g/ml). Tämä tiheyden väheneminen johtuu siitä, että vesimolekyylit "laajentavat" kiteitä, lisäämällä tilavuutta; Siksi rakenteen tiheys vähenee.
Se on melkein kaksi kertaa tiheä kuin vesi huoneenlämpötilassa. Sen veden liukoisuus on erittäin korkea, mutta etanolissa se on liukenevaa. Tämä johtuu sen orgaanisesta luonteestaan polaarisuudestaan huolimatta. Eli heksahydraatti on epäorgaaninen polaarinen yhdiste. Lopuksi, 150 ºC: n lämpötilassa se kuivuu vedettömän suolan tuottamiseksi:
Srcl2· 6H2Tai (s) => srcl2(S) + 6H2O (g)
Viitteet
- Wikipedia. (2018). Strontiumkloridi. Haettu jstk.Wikipedia.org
- Lääkekankki. (2018). Strontiumkloridi SR-89. Lääkepankki toipui.Ac
- Pubchem. (2018). Strontiumkloridi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus
- Sonni. Äiti. (2010). Rakeisen sontoniumkloridin vaikutus lisäaineena suketen sähkö- ja mekaanisiin ominaisuuksiin puhtaan polyvinyylialkoholin suhteen. Sci., Osa. 33, ei. 2, pp. 149-155. Intian tiedeakatemia.
- Ccoil. (4. syyskuuta 2009). Stoniumkloridi -xtal-3d-SF. [Kuva]. Haettu 13. huhtikuuta 2018, Commons.Wikimedia.org
- Kaikki reaktiot. SRCL2 - Sontoniumkloridi. Talteenotettu AllReactions.com