Difenyyliamiini
- 957
- 267
- Sheldon Kuhn
Mikä on defilamiini?
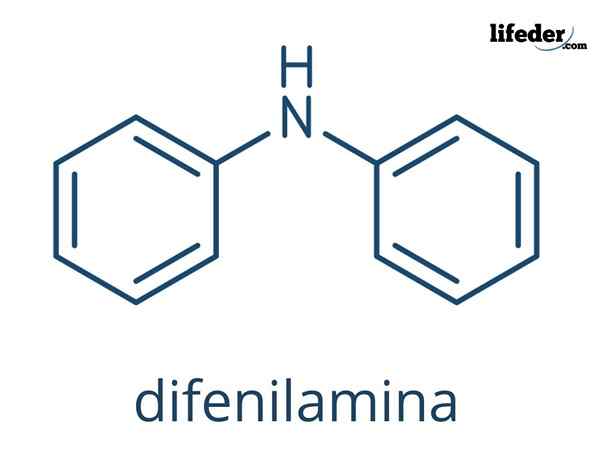
Se Difenyyliamiini Se on orgaaninen yhdiste, jonka kemiallinen kaava on (C6H5-A2Nh. Sen nimi osoittaa, että se on amiinia, samoin kuin sen kaava (-NH2-A. Toisaalta termi "diffenil" viittaa kahteen typeen liittyvään aromaattiseen renkaaseen. Näin ollen defilamiini on aromaattinen amiinia.
Orgaanisten yhdisteiden maailmassa aromaattinen sana ei välttämättä liity sen hajujen olemassaoloon, vaan ominaisuuksiin, jotka määrittelevät niiden kemiallisen käyttäytymisensä tiettyjä lajeja vastaan.

Difenyyliamiinin tapauksessa sen aromaattisuus ja tosiasia, että niiden kiinteä on erottuva aromi samaan aikaan. Sen kemiallisia reaktioita säätelevät perustan tai mekanismit voidaan kuitenkin selittää sen aromaattisella luonteella, mutta ei sen miellyttävän aromin takia.
Sen kemiallinen rakenne, emäksisyys, aromaattisuus ja molekyylien väliset vuorovaikutukset ovat muuttujia, jotka ovat vastuussa sen ominaisuuksista: sen kiteiden väristä sen sovellettavuuteen antioksidanttiaineena.
Defilamiinin kemiallinen rakenne

Ylivoimaisissa kuvissa diffenilamiinin kemialliset rakenteet ovat esitetty. Mustat pallot vastaavat hiiliatomeja, valkoisia vetyatomeista ja sinistä typpiatomiin.
Ero molempien kuvien välillä on malli siitä, kuinka ne edustavat molekyyliä graafisesti. Alemmassa se korostaa renkaiden aromaattisuutta mustalla pisteviivalla ja myös näiden renkaiden tasainen geometria on osoitettu.
Kumpikaan kuvasta ei näytä yksinäistä elektroniparia, jota ei jaettu typpiatomilla. Nämä elektronit "kävelevät" renkaiden kaksoissidosten konjugoidun π -järjestelmän läpi. Tämä järjestelmä muodostaa eräänlaisen kiertävän pilven, joka mahdollistaa molekyylien väliset vuorovaikutukset; toisin sanoen muiden molekyylin renkaiden kanssa.
Se voi palvella sinua: laboratoriolämpömittari: Ominaisuudet, mitä se on, käytä, esimerkkejäYllä oleva tarkoittaa, että ei -jaettu typpimomentti kävelee molempien renkaiden läpi, jakaen näihin elektroniseen tiheyteen ja sitten ne palaavat typeen, toistamaan sykli uudelleen.
Tässä prosessissa näiden elektronien saatavuus heikkenee, mikä johtaa dipelamiinin emäksisyyden vähentymiseen (sen taipumus lahjoittaa elektroneja Lewis -pohjana).
Dipenyyliamiinin käyttö/sovellukset
Difenyyliamiini on hapettava aine, joka pystyy toteuttamaan sarjan toimintoja, ja heidän joukossaan seuraavat:
- Omenat ja päärynöt kokevat varastossaan scalding -nimisen fysiologisen prosessin, joka liittyy konjugoidun trienosin tuotantoon, mikä johtaa hedelmien ihovaurioihin. Dipenyyliamiinivaikutus mahdollistaa varastointikauden pidentämisen vähentämällä hedelmiä, jotka vahingoittavat 10 %: ää niiden puuttuessa havaittuun.
- Hapetusta taistellessa difenyyliamiini ja sen johdannaiset laajentavat moottorien toimintaa välttämällä käytetyn öljyn sakeuttamista.
- Difenyyliamiinia käytetään otsonin vaikutuksen rajoittamiseen kuminvalmistuksessa.
- Difenyyliamiinia käytetään analyyttisessä kemiassa nitraatin havaitsemiseen (ei3-), Kloraatit (CLO3-) ja muut hapettavat aineet.
- Se on indikaattori, jota käytetään nitraattimyrkytyskokeissa.
- Kun RNA hydrolysoidaan tunnin ajan, se reagoi safilamiinin kanssa; Tämä mahdollistaa sen kvantifioinnin.
- Eläinlääketieteessä dipe -pilamiinia käytetään paikallisesti boreridimatojen ilmenemismuotojen ehkäisyyn ja hoitamiseen jalostuseläimissä.
- Jotkut duelamiinijohdannaisista kuuluvat ei-steroidisten tulehduksen vastaisten lääkkeiden luokkaan. Niillä voi olla myös farmakologisia ja terapeuttisia vaikutuksia, kuten antimikrobinen, kipulääkkeet, kouristusten antikonvulsantit ja syövän vastaisen aktiivisuuden.
Dipenyyliamiinin valmistelu
Luonnollisesti defilamiinia tuotetaan sipulissa, koroissa, vihreän ja mustan teen lehdissä ja sitrushedelmien kuorissa. Synteettisesti on monia reittejä, jotka johtavat tähän yhdisteeseen, kuten:
Aniliinin lämpöä
Se valmistetaan aniliinin lämpöä (C6H5Nh2) Hapettavien katalyyttien läsnä ollessa.
Jos aniliini tässä reaktiossa ei sisällä happiatomia sen rakenteeseen, miksi hapet? Koska aromaattinen rengas on elektronihyökkäysryhmä, toisin kuin H -atomi, joka luovuttaa sen matalan elektronisen typen tiheyden molekyylissä.
2 c6H5Nh2 => (C5H5-A2 NH+NH3
Aniliini voi myös reagoida aniliinihydrokloridisuolan kanssa (C6H5Nh3+Cl-) 230 ºC: n lämmityksen aikana kaksikymmentä tuntia.
C6H5Nh2 + C6H5Nh3+Cl- => (C5H5-A2 Nh
Fenotiatsiinireaktio
Dipenyyliamiini on peräisin useista johdettuista, kun ne yhdistetään erilaisiin reagensseihin. Yksi näistä on fenotiatsiini, joka, joka syntetisoi rikkiä, on johdannaisten edeltäjä farmaseuttisella vaikutuksella.
(C6H5-A2NH +2S => S (C6H4) NH +H2S

Dipenyyliamiiniominaisuudet
Dipenyyliamiini on valkoinen kiteinen kiinteä aine, joka sen epäpuhtauksista riippuen voi hankkia keuhkoputken, keltaisen tai keltaisen sävyn. Siinä on miellyttävä kukka -aromi, sen molekyylipaino on 169,23 g/mol ja tiheys 1,2 g/ml.
Näiden kiinteiden aineiden molekyylit ovat vuorovaikutuksessa van der Waals -voimien kanssa, joiden joukossa ovat typpiatomien (NH-NH) ja aromaattisten renkaiden pinoamisen muodostamat vety sillat lepäämällä niiden "elektroniset pilvet" toisaalta.
Voi palvella sinua: sinkkisulfidi (ZNS)Kuten aromaattiset renkaat miehittävät paljon. Yllä oleva aiheuttaa kiinteän kiinteän kiinteän fuusiopiste (53 ºC).
Nestemäisessä tilassa molekyylit ovat kuitenkin erillisempiä ja vety sillojen tehokkuus paranee. Samoin safilamiini on suhteellisen raskas, ja se tarvitsee paljon lämpöä siirtyäkseen kaasufaasiin (302 ºC, sen kiehumispiste). Tämä johtuu myös osittain aromaattisten renkaiden painosta ja vuorovaikutuksesta.
Liukoisuus ja perustavuus
Se on hyvin liukenematon veteen (0,03 g/100 g vettä) johtuen sen aromaattisten renkaiden hydrofobisesta luonteesta. Sen sijaan se on hyvin liukoinen orgaanisiin liuottimiin, kuten bentseeniin, hiilitetrakloridiin (CCL4), asetoni, etanoli, pyridiini, etikkahappo jne.
Sen happamuusvakio (PKA) on 0,79, joka viittaa sen konjugoidun hapon happamuuteen (C6H5Nh3+-A. Typpiin lisättyllä protonilla on taipumus osa, koska sen linkitetty elektronipari voi kävellä aromaattisten renkaiden läpi. Siten korkea epävakaus c6H5Nh3+ Se heijastaa diffenilamiinin matalaa emäksisyyttä.
Viitteet
- Lubrizol Corporation. (2018). Difenyyliamiini -antioksidantit. Lubrizolista palautettu.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Difenyyliamiinin ja sen johdannaisen farmakologiset sovellukset voimakkaana bioaktiivisena yhdisteenä: Katsaus. Nykyiset bioaktiiviset yhdisteet, osa 13.
- Prepchem. (2015-2016). Difenyyliamiinin valmistus. Toipunut prepchemistä.com
- Pubchem. (2018). Difenyyliamiini. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Wikipedia. (2018). Difenyyliamiini. Haettu jstk.Wikipedia.org

