Mangaanikloridiominaisuudet, rakenne, käyttö, riskit

- 2266
- 535
- Gabriel Fahey
Hän mangaanikloridi Se on epäorgaaninen suola, jonka kemiallinen kaava on MCL2. Se koostuu MN -ioneista2+ ja cl- suhteessa 1: 2; jokaiselle kationille MN2+ CL -anioneista on kahdesti-.
Tämä suola voi muodostaa useita hydraatteja: MNCL2· 2h2Tai (dihydraatti), mcl2· 4H2Tai (tetrahydraatti) ja mcl2· 6H2Tai (heksahydraatti) yleisin suola on tetrahydraatti.
 Vaaleanpunainen mangaanikloridikiteitä. Lähde: Ondřej Mangl [julkinen alue]
Vaaleanpunainen mangaanikloridikiteitä. Lähde: Ondřej Mangl [julkinen alue] Mangaanikloridin fysikaalisiin ominaisuuksiin, kuten tiheys, sulatus ja liukoisuuspisteen vedessä, vaikuttaa niiden nesteysaste. Esimerkiksi anhydran muodon sulamispiste on paljon suurempi kuin tetrahydraattimuodon.
Mangaanikloridin väri on vaaleanpunainen (ylivoimainen kuva). Kalpeus on ominaista siirtymämetallien suoloille. Mangaanikloridi on heikko Lewis -happo.
Escacquita -niminen mineraali on mangaanikloridin (II) luonnollinen vedettömä muoto; Kuin Kempita.
Mangaanikloridia (II) käytetään kevytmetalli -aineena; Katalysaattori kloorausreaktioissa jne.
[TOC]
Fyysiset ominaisuudet
Fyysinen ulkonäkö
- Anhydra -muoto: vaaleanpunaiset kuutiokiteet.
- Tetrahydraattimuoto: Hieman herkät punertavan monokliinisen kiteen.
Molaariset massat
- Anhidro: 125 838 g/mol.
- Dihydraeri: 161 874 g/mol.
- Tetrahydraatti: 197,91 g/mol.
Fuusiopisteet
- Anhidro: 654 ºC.
- Dihydraeri: 135 ºC.
- Tetrahydraatti: 58 ºC.
Kiehumispiste
Anhidra -muoto: 1.190 ºC.
Tiheys
- Vedetön: 2 977 g/cm3.
- Dihydraeri: 2,27 g/cm3.
- Tetrahydraatti: 2,01 g/cm3.
Vesiliukoisuus
Anhydra -muoto: 63,4 g/100 ml 0 ºC: ssa; 73,9 g/100 ml 20 ºC: ssa; 88,5 g/100 ml 40 ° C: ssa; ja 123,8 g/100 ml 100 ° C: ssa.
Liukoisuus orgaanisiin liuottimiin
Liukoinen pyridiiniin ja etanoliin, liukenematon eetteriin.
Hajoaminen
Ellei asianmukaisia varotoimenpiteitä ole toteutettu, hydratoitujen muotojen kuivuminen vedettömään muotoon voi aiheuttaa hydrolyyttistä kuivumista vetykloridin ja mangaanioksikloridin tuottamalla.
PHE
Vesipitoisessa tetrahydraattien mangaanikloridiliuoksessa 0,2 M liuoksessa on pH 5,5.
Voi palvella sinua: kromatogrammiVakaus
Se on stabiili, mutta herkkä kosteudelle ja yhteensopimaton vahvojen happojen, reaktiivisten metallien ja vetyperoksidin kanssa.
Mangaanikloridirakenne
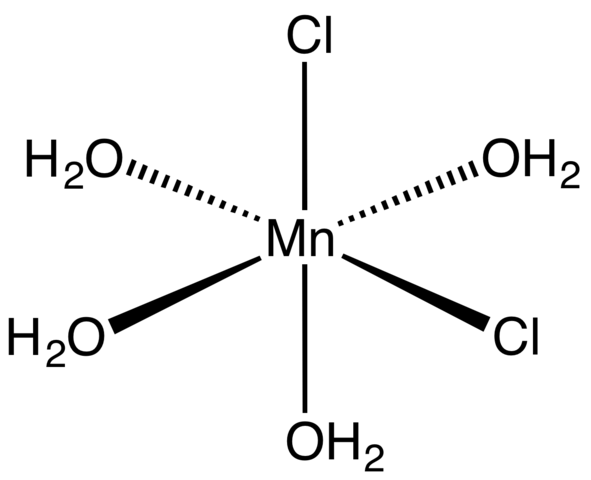 MNCL2 -tetrahydraatin koordinaatiokompleksi. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
MNCL2 -tetrahydraatin koordinaatiokompleksi. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Alkaen tetrahydraattisuolasta, vaaleanpunaisesta ja silmiinpistävistä kiteistä, se on koostettava koordinaatiokomplekseista (ylivoimainen kuva). Niissä MN -metallikeskus2+ ympäröi neljän H: n molekyylien määrittelemä oktaedron2Tai ja kaksi Cl -anionia-.
Huomaa, että Cl -ligandit- Ne ovat cis -asemissa; Kaikki ovat ekvivalentteja Octaedron suorakulmaisessa pohjassa, eikä sillä ole väliä, onko CL "siirretty"- mihin tahansa muuhun kolmeen paikkaan. Toinen mahdollinen isomeeri tälle koordinoitulle molekyylille on, jossa molemmat Cl- Ne ovat trans -asemissa; toisin sanoen eri päissä (yksi yllä ja toinen alla).
Neljä vesimolekyyliä, joissa on vety sillat, sallivat kahden tai useamman oktaedran liittyä dipoli-dipolojoukkojen avulla. Nämä sillat ovat erittäin suuntaisia, ja MN: n väliset sähköstaattiset vuorovaikutukset lisäävät2+ ja cl-, Ne luovat kidelle ominaisen järjestäytyneen rakenteen.
MNCL: n vaaleanpunainen väri2· 4H2Tai johtuu MN: n elektronisista muutoksista2+ ja sen D -kokoonpano5. Samoin vesimolekyylien ja kloridien läheisyyden aiheuttamat häiriöt modistavat tarvittavaa energiamäärää, jonka tällaiset elektronit on absorboitava5 Korkeamman energiatason matkustamiseksi.
Dihydraatti
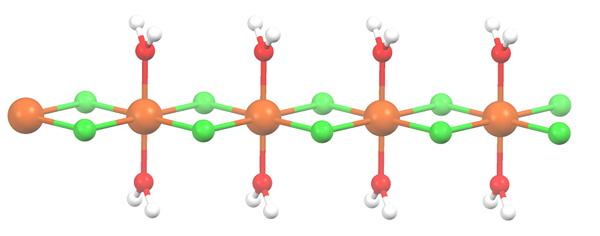 Polymeerinen rakenne MNCL2 · 2H2O: lle. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Polymeerinen rakenne MNCL2 · 2H2O: lle. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Suola on kuivunut ja sen kaavasta tulee nyt mcl2· 2h2JOMPIKUMPI. Mitä tapahtuu etuosan oktaedronille? Ei mitään, paitsi että kaksi H -molekyyliä2Tai että ne hylätään, korvataan kahdella CL: llä-.
Aluksi voit antaa väärän kuvan siitä, että CL on neljä- jokaiselle MN: lle2+; Kuitenkin puolet oktaedrosta (aksiaalisesti) on tosiasiallisesti toistuva lasin yksikkö.
Siksi on totta, että on olemassa MN2+ koordinoitu kahdella CL: llä- ja kaksi vesimolekyyliä trans -asemissa. Mutta jotta tämä yksikkö on vuorovaikutuksessa toisen kanssa, se tarvitsee kaksi CL -sillaa, mikä puolestaan sallii koordinaation oktaedron mangaanin loppuun saattamisen.
Voi palvella sinua: Diatomiset elementitCL -siltojen lisäksi vesimolekyylit tekevät yhteistyötä myös vetysitojensa kanssa siten, että tämä MNCL -ketju2· 2h2Tai älä aseista aseista.
Vedetön
Lopuksi, magnesiumkloridi on lopettanut kaiken sen kiteiden sisältämät veden menetykset; Sinulla on anhydra -suolaa nyt, mcl2. Ilman vesimolekyylejä kiteet menettävät merkittävästi vaaleanpunaisen värin voimakkuuden. Oktareedroni, kuten hydraateihin, pysyy itse mangaanin luontossa.
Ilman vesimolekyylejä, MN2+ päät, joita ympäröi oktaedri, joka koostuu vain CL: stä-. Tällä koordinaatiolinkillä on sekä kovalenttinen että ioninen luonne; Tästä syystä se viittaa yleensä MNCL: n rakenteeseen2 kuin polymeerinen kristalli. Siinä on vaihtoehtoisia MN- ja CL -kerroksia.
Nimikkeistö
Mangaanilla on monia mahdollisia hapettumisvaltioita. Sen vuoksi MNCL: n perinteinen nimikkeistö2 Sitä ei selvennetä.
Toisaalta mangaanikloridi vastaa sen tunnetuinta nimeä, johon puuttuu '(ii)', jotta se on nimikkeistökannan mukaan: mangaanikloridi (ii). Ja ASçi, on systemaattinen nimikkeistö: mangaanidikloridi.
Sovellukset
Laboratorio-
Mangaanikloridi toimii katalysaattorina orgaanisten yhdisteiden klooraamiseen.
Ala
Mangaanikloridia käytetään raaka -aineena bensiinin anti -artisanttien kehittämiseen; Ei -rautametallien hitsausmateriaali; välittäjä pigmenttien yksityiskohdassa; Ja Linaza -öljyjuoma.
Sitä käytetään tekstiiliteollisuudessa tulostamiseen ja värjäytymiseen; Tuotannossa useita mangaanisuoloja, mukaan lukien metyylisiklopentadienilmanganese -metyylisarjavärina, jota käytetään tiilivärinä; ja kuivattujen sähköakujen tuotannossa.
Mangaanikloridia käytetään kevytmetalli-aineena, ja se lisätään sulaan magnesiumiin mangaani-magnesiumseosten tuottamiseksi; välittäjänä kuivausaineiden valmistelussa maalausta ja lakkaa; ja desinfiointiaineiden osana.
Voi palvella sinua: natriumhydroksidi (NaOH): rakenne, ominaisuudet, käytöt, synteesiSitä käytetään myös magnesiumpuhdistuksessa.
Lannoite ja eläinrehu
Mangaanikloridia käytetään mangaanilähteenä, elementtiä, jota, vaikkakaan ei ensisijainen ravitsemuselementti kasveille, kuten typpi, fosfori ja kalium.
Se lisää myös jalostuseläinten ruokintaa mangaanin tarjontaan, olennainen oligoto eläinten kasvulle.
Mangaanikloridi on ruokavaliokomponentti, joka toimittaa mangaania, elementtiä, joka puuttuu lukuisiin elämää varten tarvittaviin prosesseihin, mukaan lukien: rasvahappojen ja sukupuolihormonien synteesi; E -vitamiinin assimilaatio; rustojen tuotanto; jne.
Riskejä
Se voi tuottaa kosketuksella ihon punoituksen, ärsytyksen ja pitkittyneen altistumisen ihottuman kanssa. Mangaanikloridi aiheuttaa punoitusta, kipua ja kyyneliä.
Hengittämällä suola syy, kurkkukipu ja hengityksen puute. Toisaalta nauttiminen voi tapahtua oksentelua, pahoinvointia ja ripulia.
Tämän suolan liiallinen krooninen hengitys voi johtaa hengitysteiden keuhkotulehdukseen ja myöhempaan reaktiiviseen sairauteen.
Sen liiallinen nauttiminen voi aiheuttaa mielenterveyshäiriöitä, kuivumista, hypotensiota, maksa- ja munuaisten vajaatoimintaa, moniorgaanista järjestelmää ja kuolema.
Neurotoksisuus on mangaanin epätoivotun toiminnan alkuperäinen osoitus, joka pystyy esittämään päänsärkyä, huimausta, muistin menetystä, hyperrefleksiaa ja lievää vapinaa.
Vakava toksisuus ilmenee oireista ja merkistä, jotka ovat samanlaisia kuin Parkinsonin taudissa havaitut.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Mangaani (ii) kloridi. Haettu: vuonna.Wikipedia.org
- Taivaan kevään nanomateriaalit. (2016). Mangaanikloridijauhe. Toipunut: ssnano.com
- Kemiallinen kirja. (2017). Kloridi. Palautettu: Chemicalbook.com
- Toksikologian tietoverkko. (S.F.-A. Kloridi. Toxnet. Palautettu: toxnet.Nlm.NIH.Hallitus
- Gérard Cahiez. (2001). Mangaani (ii) kloridi. doi.org/10.1002/047084289x.RM020
- Kansallinen bioteknologiatietojen keskus. (2019). Mangaanidikloridi. Pubchem -tietokanta. CID = 24480. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Webconsultas Healthcare, S.-Lla. (2019). Mineraalit: mangaani. Palautettu: Web Consoncras.com

