Lyijykloridiominaisuudet, rakenne, käyttö

- 990
- 129
- Alonzo Kirlin
Hän lyijykloridi Se on epäorgaaninen suola, jonka kemiallinen kaava on PBCLn, Missä n on lyijyn hapettumisnumero. Siten, kun lyijy on kuin +2 tai +4, suola on PBCL2 tai PBCL4, vastaavasti. Siksi tälle metallille on kahden tyyppisiä klorideja.
Kahdesta PBCL2 Se on tärkein ja vakain; kun taas PBCL4 on epävakaa ja vähemmän hyödyllinen. Ensimmäinen on ioninen luonne, jossa kationi PB2+ tuottaa sähköstaattisia vuorovaikutuksia CL -anionin kanssa- Kiteisen verkon rakentaminen; Ja toinen, on kovalenttinen, PB-CL-linkit, jotka ovat peräisin lyijy- ja klooritetraedrosta.
 Saostuneet PBCL2 -neulat. Lähde: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Saostuneet PBCL2 -neulat. Lähde: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Toinen ero lyijykloridien välillä on, että PBCL2 Se on kiinteä valkoinen lasi -muotoisia kiteitä (ylivoimainen kuva); kun taas PBCL4 Se on kellertävä öljy, joka voi kiteyttää -15ºC: ssa. PBCL -tulo2 Se on esteettisempi kuin PBCL4.
Edellä mainitun lisäksi PBCL2 Sitä löytyy luonnosta kotuniitti mineraalina; kun taas PBCL4 Ei, koska se on alttiita hajoamisille. Kun taas PBCL: stä4 Voit saada PBO: n2, PBCL2 Ne saavat loputtoman valikoiman organomethiaalisia yhdisteitä.
[TOC]
Ominaisuudet
Lyijykloridin ominaisuudet riippuvat lyijyn hapettumisnumeron olemuksesta; Koska kloori ei muutu, mutta on tapa, jolla se on vuorovaikutuksessa lyijyn kanssa. Siksi molemmat yhdisteet on puututtava; toisaalta lyijykloridi (II) ja toisaalta lyijykloridi (IV).
-Lyijykloridi (II)
Moolimassa
278,10 g/mol.
Fyysinen ulkonäkö
Neulamuodoilla varustetut valkoiset kiteet.
Tiheys
5,85 g/ml.
Sulamispiste
501ºC.
Kiehumispiste
950ºC.
Vesiliukoisuus
10,8 g/l 20ºC: n lämpötilassa. Se on vähän liukoista ja vettä on lämmitettävä siten, että huomattava määrä voidaan liuottaa.
Se voi palvella sinua: nikkelihydroksidi (II): rakenne, ominaisuudet, käytöt, riskitTaitekerroin
2,199.
Lyijykloridi (IV)
Moolimassa
349,012 g/mol.
Fyysinen ulkonäkö
Kellertävä öljyinen neste.
Tiheys
3,2 g/ml.
Sulamispiste
-15ºC.
Kiehumispiste
50ºC. Korkeammissa lämpötiloissa se hajottaa kaasumaisen kloorin vapauttamisen:
PBCL4(s) => pbcl2(s) + cl2(g)
Itse asiassa tämä reaktio voi olla hyvin räjähtävää, joten PBCL tallennetaan4 Rikkihappossa -80ºC: ssa.
Rakenne
-Lyijykloridi (II)
Aluksi mainittiin, että PBCL2 Se on ioninen yhdiste, joten se koostuu PB -ioneista2+ ja cl- että rakennetaan kide, johon perustetaan PB -suhde: Cl yhtä suuri kuin 1: 2; Eli on kaksi kertaa niin hyvin kuin cl -anionit- MITÄ KATIONIT PB2+.
Tuloksena muodostuu ortoromisia kiteitä, joiden ionit voidaan edustaa palloilla ja baarimallilla kuten alemmassa kuvassa.
 Kotuniittirakenne. Lähde: Benjah-BMM27 [julkinen alue].
Kotuniittirakenne. Lähde: Benjah-BMM27 [julkinen alue]. Tämä rakenne vastaa myös kotuniitti -mineraalin rakennetta. Vaikka tankoja käytetään osoittamaan ionisen linkin suuntaus, sitä ei pidä sekoittaa kovalenttiseen (tai ainakin puhtaasti kovalenttiseen) linkkiin).
Sanotussa ortorromisessa kiteessä PB2+ (Grillian pallot) siinä on yhdeksän Cl- (vihreät pallot) häntä ympäröivää ikään kuin hän olisi lukittu kolmion muotoiseen prismaan. Rakenteen monimutkaiselle ja PB: n alhaiselle ionitiheydelle2+, Molekyylejä on vaikea ratkaista lasia; Syy, miksi se on vähän liukoinen kylmään veteen.
Kaasumainen faasimolekyyli
Kun kide tai neste eivät voi vastustaa korkeita lämpötiloja, ionit alkavat höyrystää PBCL -molekyyleinä2 hienotunteinen; Eli CL-PB-CL-kovalenttiset sidokset ja 98º kulma ikään kuin se olisi bumerang. Sitten sanotaan, että kaasufaasi koostuu näistä PBCL -molekyyleistä2 eikä ilmavirtojen kuljettamia ioneja.
Voi palvella sinua: elektronegatiivisuusLyijykloridi (IV)
Samaan aikaan PBCL4 Se on kovalenttinen yhdiste. Koska? Koska kationi PB4+ Se on pienempi ja siinä on myös suurempi ionikuormitustiheys kuin PB2+, joka aiheuttaa CL: n elektronisen pilven suuremman polarisaation-. Tuloksena on, että ionisen tyypin PB vuorovaikutuksen sijasta4+Cl-, PB-CL-kovalenttinen linkki on muodostettu.
Tämän huomioon ottaen PBCL: n samankaltaisuus ymmärretään4 Ja esimerkiksi CCL4; Molemmat esitetään tetraedrina yksittäisinä molekyyleinä. Siksi selitetään, miksi tämä lyijykloridi on kellertävä öljy normaaleissa olosuhteissa; CL: n atomit ovat muutamia suhteessa toisiinsa ja "liukua", kun kaksi PBCL -molekyyliä4 He ovat tulossa.
Kuitenkin, kun lämpötila laskeutuu ja molekyylit hitaammin, välittömien dipolien todennäköisyys ja vaikutukset lisääntyvät (PBCL4 Se on apolaarinen ottaen huomioon sen symmetria); Ja sitten öljy jäätyy keltaisina kuusikulmaisina kiteinä:
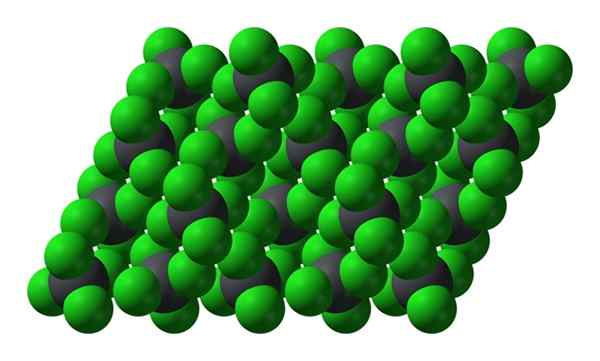 PBCL4: n kiteinen rakenne. Lähde: Benjah-BMM27 [julkinen alue]
PBCL4: n kiteinen rakenne. Lähde: Benjah-BMM27 [julkinen alue] Huomaa, että jokaista harmahtavaa palloa ympäröi neljä vihreää palloa. Nämä PBCL -molekyylit4 "Oikeus" muodostaa epävakaan kristallin ja alttiita hajoamiseen voimakkaasti.
Nimikkeistö
Nimet: Lyijykloridi (II) ja lyijykloridi (IV) vastaavat osakekannan mukaisesti osoitettuja ihmisiä. Koska hapettumisnumero +2 on pienin lyijylle ja +4 suurin, molemmat kloridit voidaan nimetä perinteisen nimikkeistön mukaan plumbose -kloridiksi (PBCL2), ja plúbic -kloridi (PBCL4), vastaavasti.
Ja lopuksi on systemaattinen nimikkeistö, joka korostaa yhdisteen kunkin atomin lukumäärää. Siten PBCL2 Se on johtava dikloridi ja PBCL4 lyijytetrakloridi.
Se voi palvella sinua: kemiallinen läpäisemätönSovellukset
PBCL: n käytännön käyttöä ei tunneta4 PBO -synteesin palvelemisen lisäksi2. Kuitenkin PBCL2 Se on hyödyllisempi, ja siksi vain jotkut tämän erityisen lyijykloridin käyttötarkoitukset luetellaan alla:
- Erittäin luminesoivan luonteensa vuoksi se on tarkoitettu valokuvan, akustisten, optisten ja säteilynilmaisimille.
- Ei absorboi infrapunaspektrialueella, sitä käytetään lasin valmistukseen, joka välittää tämän tyyppistä säteilyä.
- Hän on ollut osa sitä, mitä he kutsuvat Aureno -lasiksi, houkuttelevaksi materiaaliksi, joka on peräisin koristeellisissa tarkoituksiin käytettyjen sinertävien värien väreistä.
- Myös taideteeman seuraaminen, kun sinut tavoitetaan, PBCL2· PB (OH)2 Hanki voimakkaita valkeahkoja sävyjä valkoisen lyijypigmentin avulla. Sen käyttöä on kuitenkin lannistettu sen suuren myrkyllisyyden vuoksi.
- Sulanut ja sekoitettuna bariumtitanaatin kanssa, Batio3, Perustuu Bariumin ja Lead BA: n Titanato -keraamiseen1 - XPbxSetä3. Jos PB2+ Anna Batio3, Ba2+ Sinun on poistuttava lasista sen sisällyttämisen sallimiseksi, ja sitten sanotaan, että kationinvaihto tapahtuu; Siksi BA: n koostumus2+ Se ilmaistaan 1-x.
- Ja lopuksi PBCL: stä2 Syntetisoidaan useita formula -rumulan organimetaalisia yhdisteitä4Pb tai r3PB-PBR3.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). (II) kloridi. Haettu: vuonna.Wikipedia.org
- Kemiallinen formulaatio. (2019). Lyijykloridi (IV). Palautettu: quimica -formulaatio.com
- Clark Jim. (2015). Hiilen, piin ja lyijyn kloridit. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Spektri- ja optiset epälineaariset tutkimukset lyijykloridista (PBCL2) Kiteet. [PDF]. Toipunut: Shodhganga.Viipale.Ac.sisään
- Kansallinen bioteknologiatietojen keskus. (2019). Lyijykloridi. Pubchem -tietokanta; CID = 24459. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- « Mangaanikloridiominaisuudet, rakenne, käyttö, riskit
- Muutos kustannukset kuinka laskettu ja esimerkkejä »

