Sinkkikloridi (Zncl2) rakenne, ominaisuudet, hankkiminen, käyttö

- 2901
- 635
- Gabriel Fahey
Hän sinkkikloridi Se on epäorgaaninen yhdiste, jonka muodostaa sinkki tai sinkki elementti (Zn) ja kloori (CL). Sen kemiallinen kaava on Zncl2. CINC: tä löytyy hapetustilasta +2 ja kloorin valencia -1 -1.
Se on väritön tai valkoinen kiteinen kiinteä. Se on hyvin liukoinen veteen ja imee sen helposti ympäristöstä, joka näkyy alla esitetyn kostutetun kiinteän aineen kuvassa.
 Fifcl -kloridi2 kiinteä kiinteä. Käyttäjä: Walkerma / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Fifcl -kloridi2 kiinteä kiinteä. Käyttäjä: Walkerma / julkinen verkkotunnus. Lähde: Wikimedia Commons. Tämän yhdisteen sinkki on biologisesti erittäin tärkeä ihmisille, eläimille ja kasveille, koska se puuttuu emäksisiin toimintoihin, kuten proteiini- ja rasva -synteesiin.
Tästä syystä Zncl2 Sitä käytetään eläinten ja ihmisten ravitsemuksellisena komplementtina sinkin puutetta koskevissa tapauksissa ja kasvien mikrotravinteina.
Siinä on bakteriostaattisia ja supistavia ominaisuuksia, ja sitä käytetään laajasti näihin tarkoituksiin sekä ihmisen että eläinlääketieteen aikana. Eliminoi myös tuholaiset, kuten ulkosuut ja on välittäjä torjunta -aineiden hankkimiseksi.
Useita käyttötarkoituksiaan se käyttää selluloosan ja villakuitujen hoitoon eri prosesseissa sekä valmistaa ne väriin tai tulostamiseen. Viivästytä myös puun palamista.
[TOC]
Rakenne
Zncl2 Se on ioninen yhdiste, jonka muodostuu Zn -kationista2+ ja kaksi anionia kloridi Cl- jotka sitoutuvat sähköstaattisten voimien kautta.
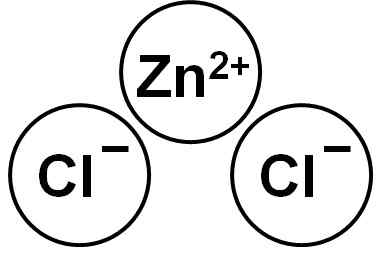 Sinkkikloridi. Kirjoittaja: Marilú Stea.
Sinkkikloridi. Kirjoittaja: Marilú Stea. Sinkin (II) ionilla on seuraava elektroninen rakenne:
1s2, 2s2 2 p6, 3s2 3P6 3D10, 4S0 -,
jossa havaitaan, että Kapin molemmat elektronit 4S, jolloin kokoonpano on vakaa.
Kloridi -ioni esittelee seuraavan rakenteen:
1s2, 2s2, 2 p6, 3s2 3P6,
mikä on myös erittäin vakaa täydellisten kiertoratojen saamiseksi.
Kuvassa voidaan havaita tapa, jolla ionit ovat saatavilla lasissa. Harmaat pallot edustavat sinkkiä ja vihreitä palloja klooriin.
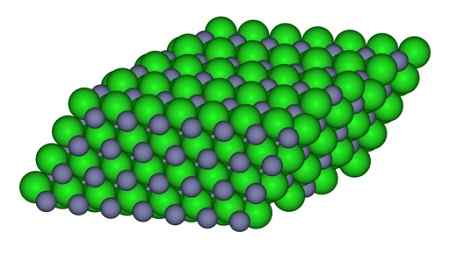 Rakenne, joka muodostaa ionit ZnCL -kidessä2. CCOIL/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Rakenne, joka muodostaa ionit ZnCL -kidessä2. CCOIL/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Nimikkeistö
- Sinkkikloridi (II)
- Sinkki -dikloridi
Ominaisuudet
Fyysinen tila
Väritön kiinteä tai kiteinen valkoinen. Kuusikulmaiset kiteet.
Molekyylipaino
136,3 g/mol
Sulamispiste
290 ºC
Kiehumispiste
732 ºC
Tiheys
2 907 g/cm3 25 ° C: ssa
Liukoisuus
Hyvin liukoinen veteen: 432 g/100 g h2Tai 25 ° C: ssa, 614 g/100 g h2Tai 100 ° C. Hydrokloorihappo (HCL), alkoholi ja glyseroli liukenee hyvin. Täysin sekoittuva.
Voi palvella sinua: Elohopeahydroksidi: rakenne, ominaisuudet, käytöt, riskitPHE
Sen vesiliuokset ovat happamia. Ratkaisu 6 moolia Zncl2/L: n pH on 1,0.
Kemialliset ominaisuudet
Se on hygroskooppinen ja herkkuyhdiste, koska se imee paljon vettä kosketuksessa ympäristön kosteuden kanssa. Vedessä se on hydrolysoitu ja sillä on taipumus muodostaa emäksinen sinkkioksikloridi liukenematon.
Reagoi sinkkioksidin (ZnO) kanssa vedessä, joka tuottaa sinkkioksiklorideja, jotka muodostavat erittäin kovan tyyppisen sementtimateriaalin.
Se on hellästi syövyttävää metalleja kohtaan.
Se ei ole syttyvä.
Biologinen rooli
Biologisesti sinkki on yksi tärkeimmistä osista. Se on tunnustettu välttämättömäksi kaikilla elämäntapoilla.
Ihmiskehossa Zncl2 Zn tarjoaa, mikä on välttämätöntä proteiinille, kolesterolille ja rasva -synteesille. Erityisesti Cinc on tärkeä immuunijärjestelmän asianmukaiselle toiminnalle.
 Sinkki Zncl2 Se on tärkeää solujen jakautumiselle elävissä olennoissa. Ladyofhats / julkinen alue. Lähde: Wikimedia Commons.
Sinkki Zncl2 Se on tärkeää solujen jakautumiselle elävissä olennoissa. Ladyofhats / julkinen alue. Lähde: Wikimedia Commons. Yli 25 sinkkiä sisältävää proteiinia on tunnistettu, ja monet näistä ovat entsyymejä, jotka ovat välttämättömiä solunjakoon ja kasvuun sekä A -vitamiinin vapautumiseen maksasta.
Cinc -puute voi johtaa kasvun, masentuneen henkisen toiminnan, anoreksian, ihottuman, immuniteetin vähentymisen, ripulin ja huonon yönäkymän kasvuun muun muassa muun muassa.
Saada
Kaupallisesti tämä yhdiste valmistetaan reagoimalla vesihapon vesihapon, sinkkijätteen tai sen sisältävän mineraalin kanssa. Tässä reaktiossa on myös kaasuvety (H2-A.
Sinkin käsittely vetykloridilla 700 ° C: ssa saadaan.
Zn + HCL → Zncl2 + H2↑
Sovellukset
Terapeuttisissa hoidoissa
Se on pehmeä tai bakteriostaattinen antibakteerinen, joten sitä käytetään emättimen suihkussa tricomonas- tai haemophilus -infektioiden eliminoimiseksi. Sen tarkoituksena on myös hoitaa kallioita, supistavana ja kemiocirugiassa ihosyövässä.
Sitä käytetään supistavana joissakin kosmetiikoissa, kuten ihon virkistävät voiteet.
Ravitsemuslisäaineena
Sen merkityksen vuoksi ihmisen organismin erilaisissa toiminnoissa Zncl2 Sitä annetaan suun kautta osana ravitsemustarvikkeita ja myös ihmisille, jotka vaativat parenteraalista ruokaa.
Zncl -lisäravinteet2 Ne toimitetaan vyöhykkeen hoitamiseksi.
Voi palvella sinua: homogeeninen seos Zncl -lisäravinteet2 Niitä tulisi käyttää, kun sinkin puute on. Kirjoittaja: Moakets. Lähde: Pixabay.
Zncl -lisäravinteet2 Niitä tulisi käyttää, kun sinkin puute on. Kirjoittaja: Moakets. Lähde: Pixabay. Terveet henkilöt hankkivat sen ruoan kautta.
Se tulisi toimittaa vähintään 1 tunti ennen aterioita tai 2 tuntia näiden jälkeen, koska jotkut ruuat voivat estää niiden imeytymisen. Potilailla, joilla on vatsan ärsytystä täydennyksen nielemisen jälkeen.
Eläinlääketieteellisissä sovelluksissa
Sen ratkaisuja on käytetty eläimissä kaustisena aineena polttaa tai kallistaa fistuleja, jotka ovat elimien välisiä yhteyksiä, jotka eivät ole normaaleja tai terveitä; Pasta -muodossa on haavaumien ja syöpäkemoterapian hoitaminen.
 Zncl: n vesiliuokset2 Niitä käytetään eläinten silmien infektioiden hoitamiseen. Kirjoittaja: Mabel Amber. Lähde: Pixabay.
Zncl: n vesiliuokset2 Niitä käytetään eläinten silmien infektioiden hoitamiseen. Kirjoittaja: Mabel Amber. Lähde: Pixabay. Silmäinfektioissa tämän yhdisteen hyvin laimennettu liuos toimii antiseptisenä ja supistavana.
Sitä käytetään myös jälkiä eläinrehussa tai elintarvikealisäosana.
Erityisissä sementeissä
Zncl: n välinen reaktio2 Ja veden ZnO tuottaa sinkkioksikloridia, jotka muodostavat erittäin kovan tai sementin materiaalin. Tärkeimmät ainesosat ovat 4zno • Zncl2• 5H2O ja ZnO • Zncl2• 2h2JOMPIKUMPI.
Tämäntyyppiset sementit vastustivat happoa tai kiehuvaa vettä. Pentahydraatti on kuitenkin erittäin stabiili ja liukenematon, mutta muuttumaton, ja dihydraatti on liukoisempi ja voi aiheuttaa nestemäistä tyhjennystä.
Näistä syistä näillä sementeillä on vähän sovelluksia.
Katalysaattorina
Se kiihdyttää joitain orgaanisia kemian reaktioita. Toimii lauhduttimen agenttina. Esimerkiksi aldoolireaktioissa aminaatioreaktiot ja syklin lisäysreaktiot. Joissakin näistä toimii radikaalina aloittajana.
Se on Lewis-happo ja katalysoi Diels-Alder-reaktioita. Sitä käytetään myös katalysaattorina Friedel-Crafts-reaktioissa, väriaineiden ja väriaineiden valmistukseen sekä polyesteripoliittisten hartsien valmistukseen.
Alla on reaktio, johon tämä yhdiste puuttuu:
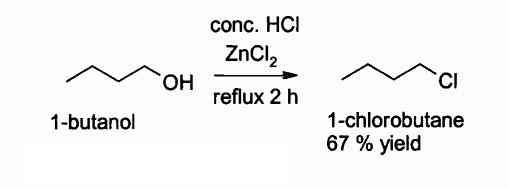 Alkyylikloridin saamisen reaktio ZnCL: n avulla2. Kirjoittaja: Walkerma. Lähde: Wikimedia Commons.
Alkyylikloridin saamisen reaktio ZnCL: n avulla2. Kirjoittaja: Walkerma. Lähde: Wikimedia Commons. Maataloudessa
Sitä on käytetty viljelykasvien rikkakasvien torjunta -aineena lehtien hoidona tuholaisten, kuten sienten ja sammalten, poistamiseksi sekä mikrotravinteina. Torjunta -aineiden valmistelu on välittäjä.
Hammassovelluksissa
Sitä käytetään suupesuissa, mutta suositeltava kosketusaika on hyvin lyhyt, joten se toimii vain supistavana oraalisessa limakalvossa. Se toimii desensibilistimenä, sitä käytetään dentifric -pastassa ja se on osa hammassementtejä.
Voi palvella sinua: natriumkloriitti (Naclo2): rakenne, ominaisuudet, käytöt, riskitTekstiili- ja paperiteollisuudessa
Se on liuottimen ainesosa, jota käytetään Rayonin valmistuksessa tai selluloosan keinotekoisessa silkissä. Se on verkko-. Se myös hoitaa heitä ja suosia heidän säilyttämistä.
Se mahdollistaa kankaat, erilliset silkki- ja villakuidut ja toimii petoksena tekstiilien tulostamisessa ja värityksessä.
Sitä käytetään paperielien valmistuksessa ja kreppipaperin tuottamiseksi.
Nanohiukkasten valmistuksessa
Reagoimalla sinkkikloridia natriumsulfidin kanssa (Na Na2S) Sinkkisulfidin (ZNS) nanohiukkasten ja tiettyjen orgaanisten yhdisteiden läsnä ollessa. Sonokemialliset menetelmät käyttävät ääniaaltoja kemiallisten reaktioiden aiheuttamiseen.
Tämäntyyppisillä nanomateriaaleilla voi olla levitys fotokatalyyttisinä aineina tuottamaan esimerkiksi vedenjakojen jakautumista komponentteihin (vety ja happi) valon vaikutuksella.
Useissa sovelluksissa
- Alueiden deodorantti, antiseptinen ja desinfiointiaine. Moss-, home- ja sienten hallinta vierekkäisissä rakenteissa ja alueilla, kuten jalkakäytävillä, pihoilla ja aidoilla. Wc: n desinfiointiaine, virtsa.
- Käytetään seoksissa embalmarissa ja liuoksia anatomisten näytteiden säilyttämiseksi.
- Puisen liekin hidastin.
- Primaarinen aineosa savupumppuissa, joita käytettiin monien ihmisten leviämiseen; Palomiehet käyttävät niitä palontorjuntaharjoituksissa ja käytännöissä.
 Cincloridia käytetään sotilaallisissa harjoituksissa käytetyissä savupumppuissa. TAI.S. Puolustusministeriön nykyinen Photoscpl. Abraham Lopez / 2nd meriosasto / julkinen alue. Lähde: Wikimedia Commons.
Cincloridia käytetään sotilaallisissa harjoituksissa käytetyissä savupumppuissa. TAI.S. Puolustusministeriön nykyinen Photoscpl. Abraham Lopez / 2nd meriosasto / julkinen alue. Lähde: Wikimedia Commons. - Hitsausvirtakomponentti. Metallilevyllä. Teräksen väritys, galvanoitu ja rautaviilun kylpyhuonekomponentti kuparin kanssa.
- Magnesium- ja metallisementtisementteissä.
- Emulsioiden katkaiseminen öljynjalostuksessa. Agentti asfaltin valmistuksessa.
- Kuivattujen akkujen elektrolyytti.
 Kuiva Zncl -akku2. Käyttäjä: 32 -bitmaschine; Toimittanut käyttäjä Jaybear/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Kuiva Zncl -akku2. Käyttäjä: 32 -bitmaschine; Toimittanut käyttäjä Jaybear/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. - Kumin vulkanointi.
- Kuivaava aine.
Riskejä
Se voi aiheuttaa palovammoja silmiin, ihoon ja limakalvoihin.
Hänen hajoamiseensa kuumennettu.
Varoitus sen käytöstä huumeidena
Vaikka ratkaisevia tutkimuksia puuttuu, arvioidaan, että jos tätä yhdistettä annetaan raskaana oleville naisille, se voi aiheuttaa vaurioita sikiölle. Mutta mahdollisilla hyötyillä voi olla enemmän painoa kuin mahdollisilla riskeillä.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kloridi -sinkki. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Liska, m. et al. (2019). Erikoissementti. Sinkkioksikloridisementti. Lea: n sementin ja betonin kemiassa (viides painos). ScienEdirect.
- Pohanish, r.P. (2017). Kloridi -sinkki. Sittigin myrkyllisistä ja vaarallisista kemikaalista ja karsioista (seitsemäs painos) käsikirjassa (seitsemäs painos). ScienEdirect.com.
- Gedanken, a. ja perelshtein, minä. (2015). Nanomateriaalien tuotannon voiman ultraääni. Power Ultrasonics. ScienEdirect.
- Archibald, s.J -. (2003). Siirtymämetalliryhmät 9-12. Reaktiot ja katalyysi. Ymmärtäessä koordinointikemia II. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- « Sinkkikromaattirakenne, ominaisuudet, hankkiminen, käyttö
- Sinkin nitraattirakenne, ominaisuudet, hankkiminen, käyttö »

