Sinkin nitraattirakenne, ominaisuudet, hankkiminen, käyttö

- 2626
- 672
- Dr. Travis Reichert
Hän sinkkinitraatti Se on epäorgaaninen yhdiste, jonka muodostaa sinkki (Zn), typpi (N) ja happi (O) -elementit (O). Sinkin hapettumistila on +2, typen on +5 ja happi on -2.
Sen kemiallinen kaava on Zn (ei3-A2. Se on yksiväritön kiteinen, jolla on taipumus absorboida vettä ympäristöstä. Se voidaan saada käsittelemällä sinkkimetallia laimennetulla typpihapolla. Se on voimakkaasti hapettava yhdiste.
 Fifr Zn -nitraatti (ei3-A2. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Fifr Zn -nitraatti (ei3-A2. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons. Se toimii orgaanisen kemian reaktioki. Sitä käytetään elektroniikan hyödyllisten materiaalien muodostamiseen.
Se on osa joitain nestemäisiä lannoitteita ja tiettyjä hitaita rikkakasvien torjunta -aineita. Auta monimutkaisten oksidien valmistuksessa parantamalla tiheyttä ja sähkönjohtavuutta.
Sitä on testattu onnistuneesti saatuaan rakenteita, jotka toimivat luukudoksen uudistamiselle ja kasvulle, parantamalla tätä prosessia ja johtaen antibakteeriseen.
Vaikka se ei ole polttoainetta, se voi nopeuttaa aineiden polttamista, kuten hiili tai orgaaniset materiaalit. Se on ärsyttävää ihoa, silmiä ja limakalvoja, ja se on erittäin myrkyllinen vesieliölle.
[TOC]
Rakenne
Sinkkinitraatti on ioninen yhdiste. Sillä on kaksisuuntainen kationi (Zn2+) ja kaksi monovalenttia anionia (ei3--A. Nitraatti -anioni on polyiatoinen ioni, joka muodostuu typen atomilla hapettumistilassa +5, joka on kiinnitetty kolmeen happiatomiin Valencian kanssa -2: sta.
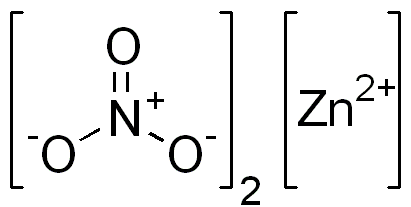 Sinkin ioninen nitraattirakenne. Edgar181 / pubi -verkkotunnus. Lähde: Wikimedia Commons.
Sinkin ioninen nitraattirakenne. Edgar181 / pubi -verkkotunnus. Lähde: Wikimedia Commons. Alla oleva kuva näyttää tämän yhdisteen alueellisen rakenteen. Harmaa keskuspallot ovat sinkkiä, siniset pallot ovat typpeä ja punaiset pallot edustavat happea.
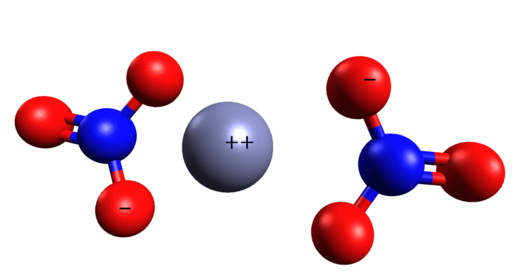 Zn: n alueellinen rakenne (ei3-A2. Cinc on keskellä nitraatti -ioneja. Grasso Luigi/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Zn: n alueellinen rakenne (ei3-A2. Cinc on keskellä nitraatti -ioneja. Grasso Luigi/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Nimikkeistö
- Cinc -nitraatti
- Sinkki -dinitraatti
Ominaisuudet
Fyysinen tila
Väritön kiinteä tai kiteinen valkoinen.
Molekyylipaino
189,40 g/mol
Sulamispiste
Noin 110 ºC.
Se voi palvella sinua: Iarhydric Acid (HI): rakenne, ominaisuudet ja käytötKiehumispiste
Noin 125 ºC.
Tiheys
2 065 g/cm3
Liukoisuus
Vesiliukoinen: 120 g/100 g H2Tai 25 ° C: ssa. Alkoholiliukoinen.
PHE
Sen vesiliuokset ovat happamia. 5%: n liuoksen pH on noin 5.
Kemialliset ominaisuudet
Nitraattina tämä yhdiste on vahva hapettiminen. Reagoi väkivaltaisesti hiilen, kuparin, metallisulfidien, orgaanisen aineen, fosforin ja rikin kanssa. Jos sitä ruiskutetaan kuumaan hiilen hyväksikäyttöön.
Toisaalta se on hygroskooppinen ja imee vettä ympäristöstä. Jos sinkkioksidimuoto, typpi- ja happidioksidi:
2 Zn (ei3-A2 + Lämpö → 2 ZnO + 4 EI2↑ + O2↑
Alkalisissa liuoksissa, kuten NaOH: n, tämän yhdisteen sinkki muodostaa sen hydroksidin ja muut monimutkaiset lajit:
Zn (ei3-A2 + 2 OH- → Zn (OH)2 + 2 Ei3-
Zn (OH)2 + 2 OH- → [Zn (OH)4-2-
Saada
Se voidaan saada käsittelemällä sinkkiä tai sinkkioksidia laimennetulla typpihapolla. Vetykaasu muodostuu tässä reaktiossa.
Zn + 2 hno3 → Zn (ei3-A2 + H2↑
Sovellukset
Reaktioiden katalyysi
Sitä käytetään katalysaattorina muiden kemiallisten yhdisteiden, kuten hartsien ja polymeerien saamisessa. Se on happamatalyytti.
 Hartsi -esimerkki. Bugman English Wikipedia / Public Domain. Lähde: Wikimedia Commons.
Hartsi -esimerkki. Bugman English Wikipedia / Public Domain. Lähde: Wikimedia Commons.  Polymeerirakenteen malli. Ilmari Karonen / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Polymeerirakenteen malli. Ilmari Karonen / Pub -verkkotunnus. Lähde: Wikimedia Commons. Toinen tapaus reaktioiden kiihtyvyydestä on Zn: n katalyyttinen järjestelmä (ei3-A2/VOC2JOMPIKUMPI4, joka mahdollistaa a-hydrolysterien hapettumisen α-Zo-stressiin 99-prosenttisella muuntamisella jopa ympäristöpaineessa ja lämpötilassa.
Yhdistelmäpolymeereissä
Polymetyylimetakrylaatti- ja ZN -kalvoja on kehitetty (ei3-A2 Sähkönjohtavuusominaisuuksilla, jotka tekevät niistä sopivia ehdokkaita käytettäväksi nopeuden supermagissa ja tietokoneissa.
Oksysfekteissä
Saadaan vesipitoisilla sinkkinitraattiliuoksilla ja sinkkioksidijauheella, saadaan materiaalit, jotka kuuluvat sementtien luokkaan.
Näillä on kohtuullinen resistenssi liuottamista laimennettuihin happoihin ja emäksisiin, ja se kehittää puristusvastuksen puristusta muihin sementtiin verrattuna.
Tämä ominaisuus kasvaa, kun ZnO/Zn -suhde kasvaa (ei3-A2, Ja kun Zn -pitoisuus ladataan (ei3-A2 Liuoksessa. Saadut sementit ovat täysin amorfisia, ts. Niillä ei ole kiteitä.
Voi palvella sinua: kemiallinen saostuminen Sinkkinitraatin kanssa sementtien saamiseksi on suoritettu. Kirjoittaja: Kobthanapong. Lähde: Pixabay.
Sinkkinitraatin kanssa sementtien saamiseksi on suoritettu. Kirjoittaja: Kobthanapong. Lähde: Pixabay. Sinkkioksidin päällysteissä ja nanomateriaaleissa
Zn (ei3-A2 Sitä käytetään hyvin ohuiden sinkkioksidin (ZnO) elektrolyyttiseen kerrostumiseen eri substraateilla. Tämän oksidin nanorakenteet valmistetaan myös pinnoille.
 Sinkkioksidin nanohiukkaset. Jotkut ZnO -nanorakenteet voidaan valmistaa Zn: llä (ei3-A2. Verena Wilhelmi, Ute Fischer, Heike Bunnardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J -. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC kirjoittanut (https: // creativecommons.Org/lisenssit/by/2.5). Lähde: Wikimedia Commons.
Sinkkioksidin nanohiukkaset. Jotkut ZnO -nanorakenteet voidaan valmistaa Zn: llä (ei3-A2. Verena Wilhelmi, Ute Fischer, Heike Bunnardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J -. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC kirjoittanut (https: // creativecommons.Org/lisenssit/by/2.5). Lähde: Wikimedia Commons. ZnO on erittäin kiinnostava materiaali, joka johtuu optleektroniikan alan monista sovelluksista, sillä on myös puolijohdeominaisuuksia ja sitä käytetään antureissa ja muunnoksissa.
Rikkakasvien torjunta -autoissa
Cinc -nitraattia on käytetty yhdessä joidenkin orgaanisten yhdisteiden kanssa tiettyjen rikkakasvien torjunta -aineiden vapautumisnopeuden vähentämiseksi vedessä. Näiden tuotteiden hidas julkaisu mahdollistaa niiden olevan saatavilla pidempään ja vähemmän sovelluksia vaaditaan.
Anodin valmistuksessa
Stimuloi sintrausprosessia ja parantaa tiettyjen oksidien tiheyttä, jotka tekevät anodit polttokennoille. Sintraus saa kiinteän materiaalin jauheen lämmityksen ja puristuksen kautta saavuttamatta sen sulautumista.
 Piirrä kuinka kaksi jyvän sintraus tapahtuu. Zn (ei3-A2 Auttaa tämän prosessin suorittamisessa joillakin monimutkaisissa oksideissa. CDang / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Piirrä kuinka kaksi jyvän sintraus tapahtuu. Zn (ei3-A2 Auttaa tämän prosessin suorittamisessa joillakin monimutkaisissa oksideissa. CDang / Pub -verkkotunnus. Lähde: Wikimedia Commons. Materiaalit, joissa testit on suoritettu, ovat strontiumin, iridiumin, raudan ja titaanin kompleksit. FAL: n läsnäolo lisää merkittävästi näiden sähkönjohtavuutta.
Muut sovellukset
Sitä käytetään huumeiden saamiseen. Se toimii petoksena musteiden ja väriaineiden soveltamisessa. Palvelee lateksikoagulanttina. Se on sinkin ja typen lähde nestemäisissä lannoitteissa.
Potentiaalinen käyttö lukukudostekniikassa
Tätä yhdistettä on käytetty lisäaineena panssarien tai kehysten kehittämisessä luukuitujen uudistamiseksi, koska se mahdollistaa näiden rakenteiden mekaanisen resistanssin parantamisen.
Voi palvella sinua: Germanio: Historia, ominaisuudet, rakenne, hankkiminen, käyttöOn havaittu, että FIFT: n sisältävä telineet eivät ole myrkyllisiä osteoprogenitorisoluille, tukee osteoblastien aktiivisuutta, jotka ovat soluja, jotka valmistavat luuta ja parantavat niiden tarttumista ja proliferaatiota.
Suosii apatitan muodostumista, joka on mineraali, joka muodostaa luut ja vaikuttaa myös antibakteeriseen vaikutukseen.
 Zn (ei3-A2 Se voi olla erittäin hyödyllistä luu -aineiden jälleenrakentamisessa ihmisillä, jotka ovat kärsineet onnettomuuksista. Mariano Coretti/CC By-Sa (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Zn (ei3-A2 Se voi olla erittäin hyödyllistä luu -aineiden jälleenrakentamisessa ihmisillä, jotka ovat kärsineet onnettomuuksista. Mariano Coretti/CC By-Sa (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Riskejä
Se on materiaali, jolla on potentiaalinen tulen ja räjähdyksen riski.
Se ei ole polttoainetta, mutta kiihdyttää palavien materiaalien polttamista. Jos suuri määrä tätä yhdistettä on mukana tulipalossa tai jos palava materiaali on hienosti jaettu, räjähdys voi tapahtua.
Tuotetaan voimakasta lämmöä altistuneita, tuotetaan myrkyllisiä typpioksideja. Ja jos altistuminen suoritetaan pitkittyväksi, se voi räjähtää.
Se ärsyttää ihoa, se voi aiheuttaa vakavia vaurioita silmille, hengitysteiden ärsytystä, se on myrkyllinen nielemisen vuoksi ja aiheuttaa ruuansulatuksen vaurioita.
Erittäin myrkyllinen vesielämälle, jolla on vaikutukset, jotka kestävät.
Viitteet
- Ju, ja. et al. (2019). Sinkkinitraatin/vanadylioksalaatin uusi vaikutus alfa-hydroksiestereiden selektiiviseen katalyyttiseen hapettumiseen alfa-keto-esineiksi molekyylin happea: an in situ. Molekyylit 2019, 24, 1281. MDPI toipui.com.
- Mohd s., S.N. et al. (2020). Sinkkihydroksidnitraatin kontrolloitu vapautumisformulaatio, joka on interkaloitu natriumdodekyylisulfen ja Bisyyribac -anionien kanssa: Uusi rikkakasvien torjunta -ainekomposiitti paddy -viljelyyn. Arabian Journal of Chemistry 13, 4513-4527 (2020). ScienEdirect.
- Mies, m.P. et al. (2019). Ylangpung -öljy- ja sinkki -nitraatin rikastettu mekaaninen lujuus ja luun mineralisaatio sähköpunun biomimeettisen telineen kanssa, joka. Polymeerit 2019, 11, 1323. MDPI toipui.com.
- Kim, k.Yllyttää. et al. (2018). Sinkkinitraatin vaikutukset sintrausapuun SR: n elecatkemiallisiin ominaisuuksiin0,92JA0,08Setä3-delta ja herra0,92JA0,08Sinä0,6Usko0,4JOMPIKUMPI3-delta Ceramics International, 44 (4): 4262-4270 (2018). ScienEdirect.com.
- Prasad, b.JA. et al. (2012). ZnO -pinnoitteen elektrodepositio vesipitoisesta Zn: stä (ei3-A2 Kylpylät: Zn -pitoisuuden, lämpötilan laskeutumisen ja ajan suuntautumisen vaikutus suuntautumiseen. J Solid State Electochem 16, 3715-3722 (2012). Linkki palautettu.Jousto.com.
- Bahadur, H. ja srivastava,.K -k -. (2007). Sol-geelin morfologiat, jotka on pyydetty ZnO: n ohutkalvoja käyttämällä erilaisia edeltäjamateriaaleja ja niiden nanorakenteita. Nanomicales Res Lett (2007) 2: 469-475. Linkki palautettu.Jousto.com.
- Nicholson, J.W -. ja Tibaldi, J.P. (1992). Sinkkioksidista valmistettujen sementin muodostuminen ja ominaisuudet ja sinkkinitraatin vesiliuokset. J Mater Sci 27, 2420-2422 (1992). Linkki palautettu.Jousto.com.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Maji, p. et al. (2015). Zn: n vaikutus (ei3-A2 PMMA: n dielektrisen demlliteetin ja sähkömoduulin täyteaine. Bull Mater Sci 38, 417-424 (2015). Linkki palautettu.Jousto.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Sinkkinitraatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Byju. (2020). Sinkin nitraatti - Zn (NO3) 2. Byjus.com.
- Amerikkalaiset elementit. Sinkkinitraatti. Toipunut amerikkalaisista.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- « Sinkkikloridi (Zncl2) rakenne, ominaisuudet, hankkiminen, käyttö
- Instituutioissa ja organisaatioissa konkreettiset eettisen menettelyn tapaukset »

