Rautakloridi (FECL2) rakenne, käyttö, ominaisuudet

- 1062
- 46
- Dr. Travis Reichert
Hän rautakloridi Se on epäorgaaninen kiinteä aine, jonka muodostaa uskon kationin liitto2+ ja kaksi anionia kloridi Cl-. Sen kemiallinen kaava on FECL2. Se pyrkii imeytymään vettä ympäristöstä. Yksi sen hydraateista on FECL -tetrahydraatti2 •4H2Tai mikä on vihertävää kiinteää.
Korosta, että se on hyvin liukoinen veteen ja pyrkii helposti hapettua ferriferrikloridin muodostavan ilman läsnä ollessa3. Sillä, että se on helposti hapettuvaa ja siksi kykenevää toimimaan pelkistimenä, käytetään laajasti kemiallisissa ja biologisissa tutkimuslaboratorioissa.
 Ferroso -tetrahydraattikloridi FECL2 •4H2Tai vankka. Craven [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Ferroso -tetrahydraattikloridi FECL2 •4H2Tai vankka. Craven [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Ferrouskloridilla on useita käyttötarkoituksia, joiden avulla muut aineet auttavat jätevesistä tai jätevesikäsittelystä johdetun lietteen hapettumisessa. Sitä käytetään myös metalliraudan pinnoitusprosessissa ja siinä on joitain käyttötarkoituksia lääketeollisuudessa.
FECL: n käyttö on myös koettu2 Ajoneuvojen pakoputkista löydettyjen käytettyjen katalyyttien arvokkaiden metallien palauttamisessa bensiinin tai dieselin kanssa työskentelevien ajoneuvojen pakoputkista.
Sitä käytetään tekstiiliteollisuudessa värien korjaamiseen tietyntyyppisiin kankaan.
[TOC]
Rakenne
Rautakloridi muodostuu rauta -ionilla2+ ja kaksi ionia kloridi Cl- Yhdistyneitä ionisten linkkien kautta.
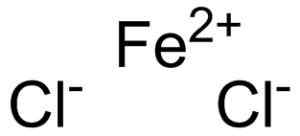 Ferroso Chloruro Fecl2 Missä ionit tekevät siitä. EPOP [julkinen alue]. Lähde: Wikimedia Commons.
Ferroso Chloruro Fecl2 Missä ionit tekevät siitä. EPOP [julkinen alue]. Lähde: Wikimedia Commons. Rautatieto2+ Sillä on seuraava elektroninen rakenne:
1s2, 2s2 2 p6, 3s2 3P6 3D6, 4S0 -
Missä voit nähdä, että kadotit kaksi 4S -kerroksen elektronia.
Tämä kokoonpano ei ole kovin vakaa, ja tästä syystä sillä on taipumus hapettua, toisin sanoen kadottaa toinen elektroni, tämä 3D -kerroksen aika, muodostaen uskon ionin3+.
Sen puolestaan ionikloridi Cl- Sillä on seuraava elektroninen rakenne:
1s2, 2s2 2 p6, 3s2 3P6
Missä voit nähdä, että olet hankkinut ylimääräisen elektronin kerroksen 3p, täydentämällä sen. Tämä kokoonpano on erittäin vakaa, koska kaikki elektroniset kerrokset ovat täydellisiä.
Nimikkeistö
- Rautakloridi
- Rautakloridi (II)
Se voi palvella sinua: Tuhkaan määrittäminen: menetelmät ja esimerkit- Rautadikloridi
- Tetrahydraatti rautakloridi: FECL2 •4H2JOMPIKUMPI
Ominaisuudet
Fyysinen tila
Värikäs tai vaaleanvihreä, kiteet.
Molekyylipaino
126,75 g/mol
Sulamispiste
674 ºC
Kiehumispiste
1023 ºC
Tietty paino
3,16 - 25 ºC/4 ºC
Liukoisuus
Hyvin liukoinen veteen: 62,5 g/100 ml 20 ºC: n lämpötilassa. Liukoinen alkoholiin, asetoniin. Liukenee hiukan bentseeniin. Käytännössä liukenematon eetterissä.
Muut ominaisuudet
FECL2 Vedetön on erittäin hygroskooppista. Absorboi vettä ympäristölle helposti muodostaen erilaisia hydraatteja, erityisesti tetrahydraattia, jossa jokaiselle FECL -molekyylille2 Molekyylejä on 4 h2Tai linkitetty tähän (FECL2 •4H2JOMPIKUMPI).
Ilman läsnä ollessa se hapettuu hitaasti FECL: lle3. Tämä tarkoittaa, että usko -ioni2+ Hapettaa ioni -uskon helposti3+.
Jos lämmität nopean ilmaferrikloridin FECL: n läsnä ollessa3 Ja rautaoksidi Fe2JOMPIKUMPI3.
FECL2 Se on syövyttävää metalleille ja kudoksille.
Saada
Se saadaan käsittelemällä ylimääräinen rauta -usko HCL -suolahappon vesiliuoksella korkeissa lämpötiloissa.
Usko0 - + 2 HCL → FECL2 + 2 h+
Veden esiintymisen vuoksi tämän menetelmän kautta saadaan kuitenkin rautatedraattikloridi2 •4H2JOMPIKUMPI.
Vetovesien saamiseksi (ilman vettä sisällytetty kiteisiin) jotkut tutkijat ovat päättäneet suorittaa rautapölyn reaktion vedettömien kukkuloiden kanssa (ilman vettä) tetrahydrofuraaniliuottimessa (THF) lämpötilassa 5 ° C.
FECL -yhdiste saadaan tällä tavalla2 •1,5ThF, joka lämmitettynä 80-85 ºC: ssa tyhjyydessä tai typen ilmakehässä (veden läsnäolon välttämiseksi) tuottaa FECL: n2 vedetön.
Sovellukset
Rautakloridilla on erilaisia käyttötarkoituksia sen pelkistyskapasiteetin perusteella, ts. Se voidaan helposti hapettua. Sitä käytetään esimerkiksi maalauksissa ja pinnoitteissa, koska se auttaa kiinnittämään ne pinnalta.
Rauta on välttämätön mikroravinne ihmisten terveydelle ja joillekin eläimille. Se osallistuu proteiinisynteesiin, solujen hengittämiseen ja kertomiseen.
Siksi FECL2 Sitä käytetään farmaseuttisissa valmisteissa. Uskon ioni2+ Sellaisena se on paremmin imeytynyt kuin usko -ioni3+ Suolistossa.
Voi palvella sinua: Kalsiumkarbonaatti: rakenne, ominaisuudet, muodostuminen, käyttötarkoituksetSitä käytetään FECL -valmistukseen3. Sitä käytetään metallurgiassa, rautapäällysteissä.
Tässä on muita näkyviä käyttötarkoituksia.
Kangasväriä
FECL2 Sitä käytetään petosten tai värityski. Mordantti reagoi kemiallisesti ja liittyy samanaikaisesti väriaineen ja kankaan kanssa, joka muodostaa liukenemattoman yhdisteen tähän.
Tällä tavalla väriaine on kiinnitetty kankaaseen ja sen väri vahvistuu.
 Rautakloridi FECL2 Mahdollistaa värien kiinnittämisen kankaisiin. Gina Pina [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons.
Rautakloridi FECL2 Mahdollistaa värien kiinnittämisen kankaisiin. Gina Pina [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons. Jäteveden hoidossa
FECL2 Sitä käytetään jätevesi- tai jätehuoltolaitoksissa (viemärivesteet).
Tässä sovelluksessa rautakloridi osallistuu mudan hapettumiseen, Fentonin hapettumisprosessin kautta. Tämä hapettuminen aiheuttaa mudan hlojen repeämän ja mahdollistaa tähän kiinnitetyn veden vapautumisen.
 Jätevedenpuhdistamo, jossa näet mutaa. Joskus tätä käsitellään Ferroso Fecl -kloridilla2 jotta se voidaan erottaa helpommin vedestä. Evelyn Simak/jätevesi toimii Dickleburghin pohjoispuolella. Lähde: Wikimedia Commons.
Jätevedenpuhdistamo, jossa näet mutaa. Joskus tätä käsitellään Ferroso Fecl -kloridilla2 jotta se voidaan erottaa helpommin vedestä. Evelyn Simak/jätevesi toimii Dickleburghin pohjoispuolella. Lähde: Wikimedia Commons. Sitten muta voi kuivua ja hylätä. Rautakloridin käyttö auttaa vähentämään prosessikustannuksia.
On myös äskettäin ehdotettu sulfidikaasun tai rikkivetyjen muodostumisen vähentämiseksi mainituissa viemärien viemäreissä.
Tällä tavalla tämän kaasun tuottama korroosio ja epämiellyttävät hajut vähenevät.
Kemiallisissa tutkimuksissa
FECL: n pelkistäville ominaisuuksille (päinvastainen hapettumiselle)2 Sitä käytetään laajasti kemian, fysiikan ja tekniikan laboratorioiden erilaisissa tutkimuksissa.
Tietyt tutkijat käyttivät rautakloridihöyryä.
Näitä katalyyttejä käytetään ihmisen ja ympäristön haitallisten kaasujen poistamiseen. Ne sijaitsevat autojen ja kuorma -autojen poistumisputkessa, jotka työskentelevät bensiinin tai dieselin kanssa.
Voi palvella sinua: molaarimassa: miten se lasketaan, esimerkkejä ja ratkaistaan harjoituksia Ajoneuvon poistoputki, jossa havaitaan laajempaa osaa, missä katalyytti sijaitsee muuttamaan haitallisia kaasuja ystävällisiksi kaasuiksi ympäristön kanssa. AHANIX1989 Englanninkielisessä Wikipediassa [julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Ajoneuvon poistoputki, jossa havaitaan laajempaa osaa, missä katalyytti sijaitsee muuttamaan haitallisia kaasuja ystävällisiksi kaasuiksi ympäristön kanssa. AHANIX1989 Englanninkielisessä Wikipediassa [julkinen verkkotunnus]. Lähde: Wikimedia Commons. Tietyn ajan kuluttua ajoneuvon katalysaattori vietetään ja menettää tehokkuuden ja sinun on korvattava se. Käytetty katalysaattori on hylätty, ja sen sisältämät arvokkaat metallit pyritään palauttamaan.
 Katalyytin keraaminen ruudukko, jossa arvokkaiden metallien jäljet FECL: n kanssa2. Global-Kat-kierrätys [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Katalyytin keraaminen ruudukko, jossa arvokkaiden metallien jäljet FECL: n kanssa2. Global-Kat-kierrätys [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Tutkijoiden mukaan rautakloridin raudalla nämä metallit muodostivat magneettiseoksia.
Seokset voitaisiin erottaa magneeteilla ja palauttaa sitten arvokkaat metallit jo tunnetuilla menetelmillä.
Biokemiallisissa tutkimuksissa
Uskon kationin hallussapidosta2+, joka on tärkeä mikrotravinteet ihmisessä ja jotkut eläimet, FECL2 Sitä käytetään biokemian ja lääketieteen tutkimuksissa.
Tietyt tutkimukset antoivat osoittaa, että rautakloridi parantaa argon -kylmän plasman siengisidistä tehokkuutta.
Kylmä plasma on tekniikka, jota käytetään lääketieteellisten pintojen ja instrumenttien sterilointiin. Se perustuu hydroksyyliradikaalien muodostumiseen OH · ympäristön kosteudesta. Nämä radikaalit reagoivat mikro -organismin soluseinämän kanssa ja aiheuttavat heidän kuolemansa.
Tässä tutkimuksessa FECL2 Kylmän plasman vaikutus parani ja kiihdytti sienenkestävän sienten eliminointia muille desinfiointimenetelmille.
Jotkut tutkijat havaitsivat, että FECL: n käyttö2 Se mahdollistaa glukoosin suorituskyvyn lisäämisen, joka saa reaktioita sokeriruo'on bagasseen perustuen.
Tässä tapauksessa usko2+ Välttämätön mikroaminen ihmisten terveydelle, sen läsnäolo tuotteen jälkeissä ei vaikuta ihmiseen.
Viitteet
- Fukuda, s. et al. (2019). Ferrouskloridi ja rautasulfaatti parantavat kylmän ilmakehän argon -plasman sienimuotoista tehokkuutta melanisoiduilla aureobasidium -pullulaneilla. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI toipunut.Clm.NIH.Hallitus.
- Ismal tai.JA. ja Yildirim, L. (2019). Metallihallit ja biomordantit. Tekstiilitekniikan vihreän kemian vaikutuksissa ja näkymissä. Luku 3, s.57-82. ScienEdirect.com.
- Zhang, W. et al. (2019). Magnesiumkloridin ja rautakloridin co-co-co-co-co-ksylo-oligosakkaridit ja glukoosituotanto sokeriruoko-bagassesta. Bioresoral Technol 2019, 291: 121839. NCBI toipunut.Nlm.NIH.Hallitus.
- Zhou, x. et al. (2015). Alkuperäiskansojen rooli lietteen vedenpoistumisen parantamisessa tämä peroksidaatio. Tieteelliset raportit 5: 7516. NCBI toipunut.Nlm.NIH.Hallitus.
- Rathnayake, D. et al. (2019). Rikkivetyjen hallinta viemäreissä katalysoimalla reaktio hapen kanssa. Ympäristön tiede 689 (2019) 1192-1200. NCBI toipunut.Nlm.NIH.Hallitus.
- Taninouchi, ja. ja Okabe, t.H. (2018). Platinum -ryhmämetallien palautuminen käytetyistä katalyytteistä käyttämällä rautakloridihöyryn käsittelyä. Metall ja Materi Trans B (2018) 49: 1781. Linkki palautettu.Jousto.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Rautakloridi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Aresta, m. et al. (1977). Rauta (0) Vetykloridin hapettuminen tetrahydrofuraanissa: Yksinkertainen tapa vedettömään rautaan (ii) kloridi. Epäorgaaninen kemia, vol. 16, ei. 7, 1977. Pubista toipunut.ACS.org.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- « Portugalin lipun historia ja merkitys (tarkistetut kuvat)
- Kristitty etiikka alkuperä, perusteet, edustajat »

