Binaaristen yhdisteiden muodostuminen, tyypit, esimerkit, nimikkeistö
- 3266
- 170
- Dr. Travis Reichert
Se binaariyhdisteet Ne kaikki muodostavat kaksi kemiallista elementtiä riippumatta niiden atomien lukumäärästä tai vuorovaikutuksesta. Näiden yhdisteiden yleinen kaava onnB -m, missä a ja b ovat jaksollisen taulukon kaksi eri elementtiä ja n ja m heidän vastaavat stoikiometriset kertoimet.
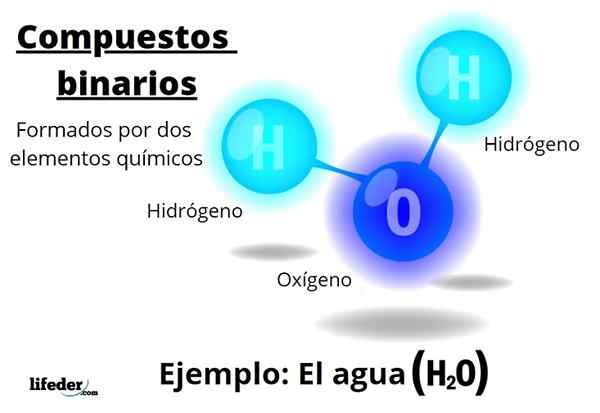
Esimerkiksi vesi, h2Tai se on binaarinen yhdiste, joka on ehkä edustava heistä. Vesi koostuu vedystä, H: stä ja hapesta tai lisäämällä siten kaksi kemiallista elementtiä. Huomaa, että sen stökiometriset kertoimet osoittavat, että vetyä ja yksi happiatomia on kaksi, mutta se on silti binaarinen yhdiste.

Binaariset yhdisteet voivat koostua ioneista, molekyyleistä, kolmen dimensioisista verkoista tai jopa neutraaleista metalliatomeista. Tärkeää on, että sen kemiallisen sidoksen tai sen koostumuksen luonteesta muodostuu aina kaksi erilaista kemiallista elementtiä. Esimerkiksi vetykaasu, H2, ei lasketa binaariseksi yhdisteeksi.
Binaariset yhdisteet eivät välttämättä näytä alun perin niin runsasta ja kompleksista verrattuna kolmeen tai kvaternääriseen yhdisteeseen. Niiden joukossa on kuitenkin monia tärkeitä aineita maanpäällisissä ekosysteemeissä, kuten suolat, oksidit, sulfidit ja jotkut valtavan biologisen ja teollisen arvon kaasut.
[TOC]
Kuinka binaariset yhdisteet ovat?
Valmistusmenetelmät tai synteettiset reitit binaaristen yhdisteiden muodostamiseksi riippuvat kahden kemiallisen elementin a ja b identiteetistä. Periaatteessa ja yleensä molemmat elementit on kuitenkin yhdistettävä reaktorissa, jotta ne voivat olla vuorovaikutuksessa keskenään. Siten, jos olosuhteet ovat suotuisat, kemiallinen reaktio tapahtuu.
Kemiallinen reaktio, elementit A ja B liittyvät tai yhdistävät (ioninen tai kovalenttisesti) yhdisteen muodostamiseksinB -m. Monet binaariset yhdisteet voidaan muodostaa niiden kahden puhtaan elementin suoralla yhdistelmällä tai noudattamalla muita taloudellisesti kannattavia vaihtoehtoisia menetelmiä.
Se voi palvella sinua: sinkkioksidi (ZnO): rakenne, ominaisuudet, käytöt, riskitPalaa veteen, vedyn, H: n esimerkkiin2, ja happi tai2, Ne yhdistyvät korkeissa lämpötiloissa siten, että niiden välillä on palamisreaktio:
2H2(g) + tai2(g) → 2h2O (g)
Toisaalta vettä voidaan saada yhdisteiden, kuten alkoholien ja sokerien, kuivumisreaktioiden avulla.
Toinen esimerkki binaarisen yhdisteen muodostumisesta vastaa rautasulfidia, FES:
Usko (t) + s (s) → fes (s)
Missä tällä kertaa sekä rauta että rikki ovat kiinteitä eivätkä sooda -aineita. Ja tämä on sama useiden binaaristen suolojen, esimerkiksi natriumkloridin, NaCl: n kanssa, yhdistämällä metallisen natriumin kloorikaasuihin:
2NA (S) + CL2(g) → 2nacl (s)
Nimikkeistö
Kaikkien binaaristen yhdisteiden nimiä säätelevät enimmäkseen samat säännöt.
VartennB -m, Nimi B mainitaan ensin anionisessa muodossaan; eli loppupäällä -RO: lla. Kuitenkin siinä tapauksessa, että B koostuu hapesta, se on nimetty oksidiksi, peroksidiksi tai superoksidiksi.
B: n nimeä edeltää kreikkalaisten numeroiden etuliitteet (mono, di, tri, tetra jne.) m.
Lopuksi mainitaan elementin A nimi. Jos sillä on useampi kuin yksi valenssi, se on merkitty roomalaisilla numeroilla ja suluissa. Tai jos haluat, voit valita perinteisen nimikkeistön ja käyttää jälkiliitteitä -ooso e -ico. Elementti A joskus edeltää myös kreikkalaisten numeroiden etuliitteet n.
Harkitse seuraavia binaarisia yhdisteitä yhdessä niiden nimien kanssa:
-H2O: Vetyoksidi tai dihydrogeenimonoksidi (tämä sukunimi on syy kiusantekoon)
-FES: Rautasulfidi (II) tai rautasulfidi
-NaCl: Natriumkloridi tai natriumkloridi
Voi palvella sinua: Öljy- tai bensiinieetteri: kaava, rakenne, käyttötarkoitukset-Mgcl2: Magnesiumkloridi, magneettinen kloridi tai magnesiumdikloridi
Huomaa, että "monosodiumkloridi" tai "monohierro -sulfidi" ei sanota.
Tyypit: binaaristen yhdisteiden luokittelu
Binaariset yhdisteet luokitellaan muodostuneiden tai tosiasioiden mukaan: ionit, molekyylit, metalliatomit tai verkot. Silti tämä luokittelu ei ole täysin vakuuttava tai lopullinen, kyky vaihdella tarkasteltavasta lähestymistavasta riippuen.
Ioninen
Ionisissa binaarisissa yhdisteissä A ja B koostuvat ioneista. Siten yhdisteeksinB -m, B on yleensä anioni, b-, Kun taas kationi+. Esimerkiksi NaCl kuuluu tähän luokitteluun, samoin kuin kaikkiin binaarisuoloihin, joiden yleiset kaavat esitetään paremmin MX: nä, missä X on anioni ja M -metallinen kationi.
Siten fluoridit, kloridit, bromurot, jodidi., He kuuluvat myös tähän luokitteluun. On kuitenkin huomattava, että jotkut heistä ovat kovalenttisia, siksi kuuluvat seuraavaan luokitteluun.
Kovalenttinen
Kovalenttiset binaariset yhdisteet muodostuvat molekyyleillä. Vesi kuuluu tähän luokitteluun, koska se koostuu H-O-H-molekyyleistä. Vetykloridia, HCL: tä, pidetään myös kovalenttisena binaariyhdisteenä, koska se koostuu H-CL-molekyyleistä. Huomaa, että NaCl on ioninen, kun taas HCl on kovalenttinen, molemmat kloridit ovat.
Metalli tai verkkot
Binaariset yhdisteet kattavat myös kolmen dimensionaalisten verkkojen seokset ja kiinteät aineet. Heille binaarimateriaalien nimeämistä käytetään kuitenkin yleensä paremmin.
Esimerkiksi messinkiä, enemmän kuin yhdistettä, pidetään binaarimateriaalina tai seoksena, koska sen muodostavat kupari ja sinkki, cu-zn. Huomaa, että sitä ei ole kirjoitettu sillä, ettei ole määritelty stökiometriset kertoimet.
Samoin siellä on piisidioksidia, SiO2, muodostettu pii ja happi. Niiden atomit yhdistetään määrittelemällä kolmiulotteinen verkko, jossa et voi puhua molekyyleistä tai ioneista. Monet nitridit, fosfoni ja karbidit, kun ne eivät ole ionisia, koskevat myös tämän tyyppisiä verkkoja.
Voi palvella sinua: fenoksietikkahappo: synteesi, menettely, käyttö, riskitEsimerkkejä binaarisista yhdisteistä
 Vesi on esimerkki binaarisesta yhdisteestä
Vesi on esimerkki binaarisesta yhdisteestä Se luetellaan useiden binaaristen yhdisteiden loppuun saattamiseksi heidän nimensä mukana:
-Libr: Litiumbromidi
-Kacl2: kalsiumkloridi
-FECL3: rautakloridi (III) tai ferrikloridi
-NAO: Natriumoksidi
-Tarra2: Beryllium -hydridi
-Yhteistyö2: hiilidioksidi
-Nh3: Typpi- tai ammoniakkiarhydridi
-BKT2: Lyijy jodidi (ii) tai lyijy Diyoduro
-Mg3N2: Magnesium nitruro
-Siihen2JOMPIKUMPI3: Alumiinioksidi tai diauminumitrioksidi
-Naa3K: Natriumfosfuro
-Alf3: Alumiinifluori
-Racl2: radiokloridi tai radiodikloridi
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: volframikarbidi tai Wolframium
Jokaisella näistä esimerkeistä voi olla useampi kuin yksi nimi kerrallaan. Näistä CO2 Sillä on suuri vaikutus luontoon, koska kasvit käyttävät sitä fotosynteesissä.
Toisaalta NH3 Se on yksi aineista, joilla on teollisin arvo, joka on välttämätön polymeerisen ja orgaanisen synteesin synteesille. Ja lopuksi, WC on yksi kaikkien aikojen vaikeimmista materiaaleista.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Artem Cheprasov. (2020). Mikä on binaarinen yhdiste? - Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Määritelmä binaarinen yhdiste. Toipunut: Admingco.com
- Byju. (2020). Mitkä ovat binaariset yhdisteet? Toipunut: byjus.com
- Kemia. (S.F.-A. Metallien binaariset yhdisteet, joissa on kiinteät varaukset. Talteenotettu: ChemTeam.Tiedot
- Wikipedia. (2020). Binaarivaihe. Haettu: vuonna.Wikipedia.org
- « Nitriittien ominaisuudet, rakenne, nimikkeistö, koulutus
- Reaktioflokkulaatio, tyypit, sovellukset, esimerkit »

