Nitriittien ominaisuudet, rakenne, nimikkeistö, koulutus
- 670
- 108
- Arthur Terry II
Se nitriitit Ne ovat kaikki ne yhdisteet, jotka sisältävät anionia2-, Jos ne ovat epäorgaanisia tai ryhmä -ono, jos he ovat orgaanisia. Suurin osa on metalli -nitriittejä, jotka ovat epäorgaanisia suoloja, joissa ei2- vuorovaikutuksessa sähköstaattisesti C -kationien kanssan+; Esimerkiksi natriumkationi, na+.
Siten natriumnitriitti, nano2, Se on esimerkki suola- tai nitriittiyhdisteestä. Näitä suoloja löytyy luonnosta joko maaperässä, merissä, nisäkkäissä ja kasvikudoksissa, koska ne ovat osa typen biologista sykliä. Siksi ei2- Se on organismeissamme läsnä oleva aine, ja se on yhteydessä verisuonia laajentaviin prosesseihin.
 Tilaa täynnä nitriittien anionia. Lähde: Benjah-BMM27.
Tilaa täynnä nitriittien anionia. Lähde: Benjah-BMM27. Nitriitistä tulee pienempi typen muoto tai vähemmän hapettuneita kuin nitraatti, ei3-. Typpioksidi tapahtuu siitä, ei organismin alueilla, joilla on happea puute. Hän ei ole signalointimolekyyli, jolla on verisuonia laajentavaa vaikutusta rentouttamalla lihaksia ja valtimoita.
Biokemian ja lääketieteen ulkopuolella nitriittejä käytetään bakteerisidinä, ne ovat niiden aggregaatio melko yleisiin lihaan. Tämä tarkoituksena on parantaa heitä ja laajentaa niiden laatua ja raikkautta pidempään.
Nitriittillä on kaksi kasvoja: yksi hyödyllinen terveydelle ja toinen, joka asettaa sen vaaraan. Hyvät kasvot johtuvat juuri reaktioista, jotka vähentävät sitä ei. Samaan aikaan huonot kasvot johtuvat sen muutoksesta nitrosamiiniksi: orgaanisten yhdisteiden perhe, jolla on useita jäseniä, jotka on tunnustettu syöpää aiheuttaviksi aineiksi.
[TOC]
Nitriittien ominaisuudet
Perusteetti
Nitriitit ovat perussuoloja, koska anioni ei2- Se on typpihapon konjugoitu emäs, HNO2-
Hno2 + H2Tai ⇌ EI2- + H3JOMPIKUMPI+
Vedessä ja muutamana määrin se hydrolysoidaan OH -ionien perustamiseksi--
EI2- + H2Tai ⇌ hno2 + vai niin-
Tämä emäksisyys on luontainen kaikille nitriittisuoloille, koska se riippuu ei2- eikä häntä seuraavista kationeista. Nämä kationit ja niiden vuorovaikutus no: n kanssa2- Ne vaikuttavat nitriittisuolojen liukoisuuteen vedessä ja muissa polaarisissa liuottimissa.
Reaktiot
Nitriittien reaktiot vaihtelevat riippuen siitä, mitkä kationit seuraavat2-, tai onko se orgaaninen nitriitti, Rono. Yleisesti ottaen nitriitit voivat hajottaa, hapettaa tai vähentää: metallioksideja, ei3-, EI2, Ei ja jopa typpikaasu, n2.
Voi palvella sinua: termodynaamiset prosessitEsimerkiksi ammoniumnitriitti, NH4EI2 voi hajota n2 ja h2JOMPIKUMPI.
Fyysiset esiintymiset
Lähes kaikki nitriitit ovat kiteisiä kiteisiä ulkonäköä. Monet ovat valkeahkoja tai kellertäviä värejä, vaikkakin värikkäitä, jos ne sisältävät siirtymämetallien kationeja.
Toisaalta enimmäkseen orgaaniset nitriitit ovat erittäin epävakaita ja räjähtäviä haihtuvia nesteitä.
Rakenne
Nitriittien anionin
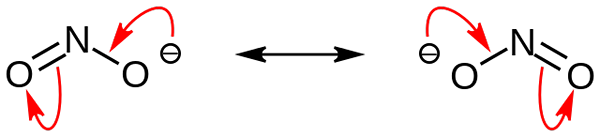 Nitrite -anioniresonanssirakenteet. Lähde: Nehingserius / Pub -verkkotunnus
Nitrite -anioniresonanssirakenteet. Lähde: Nehingserius / Pub -verkkotunnus Ensimmäisessä kuvassa nitriitti -anioni esitettiin täydellä avaruusmallilla. Tällä mallilla on haitta, joka on täsmälleen sama kuin typpidioksidi, ei2. Toisaalta ylivoimainen kuva kuvaa nitriitti -anionia paremmin ja kuinka sen negatiivinen kuorma käyttäytyy.
Tämä kuorma siirretään kahden happiatomin väliin, joten jokaisella on puolet mainitusta negatiivisesta kuormasta (-1/2). Ja juuri tämä negatiivinen taakka, joka vastaa ympäröivien kationien houkuttelemisesta yksinkertaisen sähköstaattisen vetovoiman vuoksi.
Kiintoaine
Epäorgaaniset nitriitit ovat kaikki kiteisiä kiinteitä yhdisteitä. Sen vuorovaikutukset ovat puhtaasti sähköstaattisia, sillä niissä on vetovoima2- ja kationit mn+. Siten esimerkiksi nano2 Sillä on ortorrominen kiteinen rakenne, ja se muodostuu Na -ioneista+ ja ei2-.
Kiteisen rakenteen tyyppi riippuu m: n identiteetistä+n, Joten kaikilla nitriitteillä ei ole ortorromista rakennetta.
Orgaaniset nitriitit
Orgaaniset nitriitit, toisin kuin epäorgaaniset yhdisteet, eivät ole ionisia yhdisteitä, vaan kovalenttisia. Siksi ne muodostetaan molekyyleistä, joille on ominaista R-AON-linkki, jossa R voi olla alkyyli- tai aromaattinen ryhmä.
Niitä pidetään typpihappoestereinä, koska heidän vety, H-DON, korvataan R-ryhmällä:
 Yleinen kaava orgaaniselle nitriittille. Lähde: PNGBOT Wikipedian kautta.
Yleinen kaava orgaaniselle nitriittille. Lähde: PNGBOT Wikipedian kautta. Ylemmän kuvan mukaan tämä esteri voitaisiin kirjoittaa Rum = O, hyvin samanlainen kuin hiiliesterien kaava, ROC = O. Huomaa suuri samankaltaisuus, joka tällä rakenteella on nitroyhdisteiden rakenteessa, RNO2, missä nyt päälinkki on R-ei2 eikä r-dono. Ainoa ero on siis atomisessa, johon se liittyy2 ryhmään r.
Tästä syystä nitriittiestereitä ja nitroyhdisteitä pidetään linkki -isomeereinä, koska niillä on samat atomit, mutta linkitetään eri tavalla.
Kompleksi
Nitriittikomplekseilla voi olla sekä epäorgaanisia että orgaanisia komponentteja. Ne muodostavat koordinaatioyhteyden metallikeskuksen ja yhden No -hapen välillä2-. Eli puhtaasti sähköstaattisesta vuorovaikutuksesta ei ole puhetta, mn+EI2-, mutta koordinointia mn+-TAI EI-.
Voi palvella sinua: mitkä ovat aineen fysikaaliset ominaisuudet?Orgaaniset nitriitit ja niiden kompleksit muodostavat tai eivät ole kiteisiä rakenteita riippuen siitä, onnistuvatko niiden vuorovaikutukset asettamaan hiukkaset avaruuteen.
Nimikkeistö
Epäorgaaniset ja orgaaniset nitriitit jakavat huomattavasti yksinkertaisen nimikkeistön. Niiden nimeämiseksi sanat 'nitriitti', jota seuraa metallin nimi ja suluihin kirjoitettu valenssi on ensin sijoitettu. Samoin pääte -cco ja -sso siinä tapauksessa, että Valenciaa on enemmän kuin yhtä.
Esimerkiksi cuno2 voidaan nimetä kahdella tavalla: kuparinitriitti (I) tai kupion nitriitti.
Tämä nimikkeistösääntö koskee myös orgaanisia nitriittejä. Esimerkiksi Cho3Onoa kutsutaan Methilo -nitritoksi, koska ch3 vastaa ryhmää R -kytkettynä ei -happea2.
Nimikkeistöstä voi tulla monimutkaista, jos on muitakin yhtä suuria tai suurempia kemiallisia merkityksiä kuin ei2, tai jos ne ovat metallikomplekseja.
Koulutus
Nitrifikaatio
Monet epäorgaaniset nitriitit muodostuvat luonteeltaan yhdessä typpisyklin vaiheista: nitrifikaatio. Tämä prosessi koostuu mikro -organismien suorittamien ammoniakin hapettumisesta erityisesti nitrosomonasbakteerien avulla.
Nitrifikaatio kattaa myös nitraatin myöhemmän hapettumisen nitraattiin; Nitriitin muodostuminen on kuitenkin näiden reaktioiden hidas vaihe, koska se vaatii suurempaa energiaa ja sen on voitettava suurempi kineettinen este.
Seuraava yhtälö on esimerkki äskettäin paljastuneista:
2NH4+ + Kolmas2 → 2no2- + 4H+ + 2H2JOMPIKUMPI
Useita entsyymejä osallistuu tähän reaktioon ja tuotetaan hydroksyyliamiinia, NH2Voi, joka on tuote, josta nitriitti -anionit lopulta ovat peräisin.
Kasvit sisältävät nitriittejä ja puolestaan nitrifikaatiota ja puolestaan niitä kuluttavat eläimet. Nitriittejä ei ole vain maaperässä, vaan myös merillä, ja melkein kaikki niiden luonnollinen tuotanto johtuu erilaisten mikro -organismien oksidatiivisesta ja anaerobisesta vaikutuksesta.
Typpioksidit emäksisissä väliaineissa
Alkalimetallien nitriitit voidaan valmistaa teollisesti kupistamalla typpioksideja emäksisissä liuoksissa tai väliaineissa joko niiden vastaavista hydroksideista tai karbonaateista. Esimerkiksi natriumnitriitti tapahtuu seuraavan reaktion mukaan:
Ei +ei2 + NaOH → 2nano2 + H2JOMPIKUMPI
Ammoniumnitriitin tapauksessa dyitppitrioksidi on kuplattu ammoniakkiin:
Voi palvella sinua: Rodio: Historia, ominaisuudet, rakenne, käyttö, riski2NH3 + H2Tai +n2JOMPIKUMPI3 → 2NH4EI2
Reaktio typpioksidin kanssa
Alquilico -nitriitit, Rono, voidaan syntetisoida reaktiolla. Yleinen reaktio olisi seuraava:
R-OH → R-AON
Nitriittien sovellus
Lihankovetus
 Lihan punertavan väri johtuu sen parannusta nitraattisuoloilla ja nitraatilla. Lähde: Pxhere.
Lihan punertavan väri johtuu sen parannusta nitraattisuoloilla ja nitraatilla. Lähde: Pxhere. Nitriitteillä on antibakteerisia vaikutuksia, joten niitä lisätään kohtalaisina määrinä lihaan hoitamaan mätänsä. Tämän toiminnon suorittamisen lisäksi ne reagoivat lihaproteiinien kanssa antaakseen heille punertavan ja houkuttelevamman värisen värjäyksen.
Tämän käytännön huono puoli on, että joillakin lihalla voi olla liian monta nitriittisuolaa, ja keittäessäsi niitä korkeissa lämpötiloissa, ne muuttuvat nitrosoamiiniksi. Siksi on riski lisätä jonkin tyyppistä syöpää saadaksesi mahdollisuuksia, jos näiden kovetetun lihan kulutus on liiallista.
Sauvavärit
Nitriittejä käytetään orgaanisessa kemiassa diatsotaatioreaktion toteuttamiseen, jonka kanssa väritys tai väriaineet syntetisoidaan.
Pigmentit
Joitakin nitriittikomplekseja, kuten kobolttia, voidaan käyttää pigmentteinä maalauksille tai posliinille niiden silmiinpistävien värien vuoksi.
Verisuoniaine
Nitriitit ovat vastuussa typpioksidin tuottamisesta kehossa puutteellisilla happealueilla. Hän ei ole signalointimolekyyli, joka reagoi verisuoniin rentouttaen ja laajentuvan. Tällä laajentumisella tai laajenemisella on seurauksena, että verenpaine laskee.
Esimerkkejä nitriiteistä
Lopuksi, joitain esimerkkejä nitriiteistä luetellaan niiden kaavoilla ja nimillä:
-Vanhempi veli2: natriumnitriitti
-Kno2: kaliumnitriitti
-Mg (ei2-A2: Magnesiumnitriitti
-Rypäle2-A2: kalsiumnitriitti
-CH3CH2Ono: etyylitriitti
-Nh4EI2: Ammoniumnitriitti
-Zn (ei2-A2: sinkkimitriitti
-PB (ei2-A2: Lyijy nitriitti (ii) tai plumbose -nitriitti
-Usko (ei2-A3: Rautanitriitti (III) tai rauta -nitriitti
-(CH3-A2Shakki2CH2Ono: Isoamilo Nitrito
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Nitriitti. Haettu: vuonna.Wikipedia.org
- Elsevier B.V. (2020). Nitriitti. Tiede. Haettu: ScienEdirect.com
- Alfa Aesar. (2020). Nitriittisuolat. Themo Fisher Scientific. Toipunut: Alfa.com
- Enyclopaedia Britannica -toimittajat. (23. helmikuuta 2018). Nitriitit. Encyclopædia britannica. Toipunut: Britannica.com
- Anthony r. Butler & Martin Feelisch. (22. huhtikuuta 2018). Epäorgaanisen nitriitin ja nitraatin terapeuttinen käyttö. doi.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10. helmikuuta 2020). Ovat nitraatit ja nitriitit elintarvikkeissa haitallisia? Toipunut: Healthline.com
- « Sosiaalisen käyttäytymisen teoria, tyypit, normit, esimerkit
- Binaaristen yhdisteiden muodostuminen, tyypit, esimerkit, nimikkeistö »

