Kvaternääriset yhdisteet ominaisuudet, koulutus, esimerkit
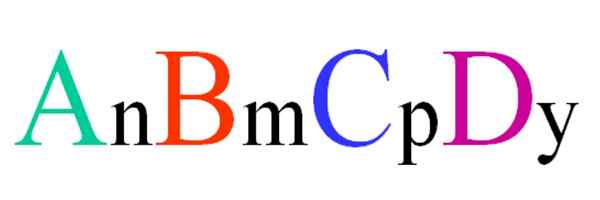
- 1818
- 451
- Gabriel Fahey
Se Kvaternääriset yhdisteet He ovat kaikki niitä, joilla on neljä erilaista atomia tai ionia. Siksi ne voivat olla molekyyli- tai ionisia lajeja. Sen monimuotoisuus kattaa sekä orgaanisen että epäorgaanisen kemian, joka on erittäin tilaa vievä ryhmä; Vaikka ehkä, ei niin paljon verrattuna binaarisiin tai kolmeen kolmeen yhdisteeseen.
Syy, että numerosi on pienempi. Kaikki elementit eivät ole yhteensopivia keskenään ja vielä vähemmän, kun niitä pidetään kvartettina; Yhtäkkiä pari heistä liittyy enemmän toisiinsa kuin toisen parin kanssa.
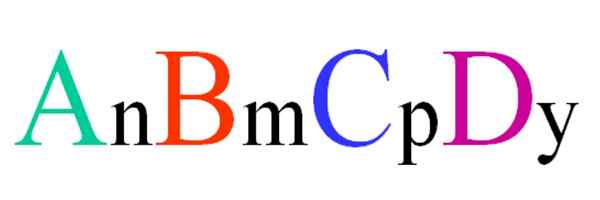 Yleinen ja satunnainen kaava kvaternääriselle yhdisteelle. Lähde: Gabriel Bolívar.
Yleinen ja satunnainen kaava kvaternääriselle yhdisteelle. Lähde: Gabriel Bolívar. Harkitse ABCD -satunnaisen kaavan kvaternääristä yhdistettä. Tilaukset n, m, p e y ovat stoikiometrisiä kertoimia, jotka puolestaan osoittavat, mikä osuus jokaisesta atomista on suhteessa muihin.
Siten kaava anB -mCpD -dja Se on voimassa, jos se täyttää elektroneutraalisuuden. Lisäksi tällainen yhdiste on mahdollinen, jos niiden neljä atomia ovat riittävän lähellä toistensa kanssa. Nähdään, että tätä kaavaa ei sovelleta moniin yhdisteisiin, vaan erityisesti seoksiin tai mineraaleihin.
[TOC]
Kvaternääristen yhdisteiden ominaisuudet
Kemikaalit
Kvaternäärinen yhdiste voi olla ioninen tai kovalenttinen, mikä osoittaa luonteensa odotetut ominaisuudet. ABCD -ionisten yhdisteiden odotetaan liukenevan veteen, alkoholiin tai muihin polaarisiin liuottimiin; Heillä on oltava korkeat kiehumis- ja fuusiopisteet, ja ne ovat hyviä sähkönkuljettajia sulautuessaan.
ABCD -kovalenttisten yhdisteiden suhteen suurin osa koostuu typestä, hapetettuista tai halogenoiduista orgaanisista yhdisteistä; toisin sanoen sen kaavasta tulee cnHmJOMPIKUMPIpNja tai cnHmJOMPIKUMPIpXja, X on halogeeniatomi. Näistä molekyyleistä olisi loogista ajatella, että ne olivat polaarisia, kun otetaan huomioon O: n ja x.
Voi palvella sinua: natriumkloridi (NaCl)Puhtaasti kovalenttisella ABCD-yhdisteellä voi olla monia linkkien mahdollisuuksia: A-B, B-C, D-A jne., Atomien sukulaisuuksista ja elektronisista ominaisuuksista riippuen. Vaikka puhtaasti ionisessa ABCD -yhdisteessä sen vuorovaikutukset ovat sähköstaattisia: a+B --C+D -d-, Esimerkiksi.
Seoksen tapauksessa, jota pidetään enemmän kiinteänä seoksena kuin asianmukaisesti ottaen yhdiste, ABCD koostuu neutraaleista atomeista perustiloissa (teoriassa).
Muista ABCD -yhdiste voi olla neutraali, happo tai emäksinen, sen atomien identiteetistä riippuen.
Fyysinen
Fyysisesti ottaen on todennäköistä, että ABCD: stä ei tule kaasua, koska neljään eri atomiin liittyy aina suurempi molekyylimassa tai formuloitu. Jos se ei ole neste, jolla on korkea kiehumispiste, sen odotetaan olevan kiinteä, jonka hajoamisen on tuotettava monia tuotteita.
Jälleen sen värit, haju, rakenne, kiteet jne., Heille kohdistuu siihen, kuinka he ovat samanaikaisesti A, B, C ja D yhdisteessä, ja ne riippuvat heidän synergiastaan ja rakenteistaan.
Nimikkeistö
Toistaiseksi kvaternääristen yhdisteiden kysymystä on käsitelty globaalilla ja epätarkkaalla tavalla. Orgaanisen kemian jättäminen syrjään (amidas, benchilokloridit, kvaternääriset ammoniumsuolat jne.), Epäorgaanisessa kemiassa on hyvin määriteltyjä esimerkkejä, joita kutsutaan happamiksi ja emäksisiksi oksiksille.
Happosioksit
Happosioksit ovat ne, jotka johtuvat polyproottisen oksoasidin osittaisesta neutraloinnista. Siten yksi tai useampi sen hydrogeista korvataan metallikationeilla, ja mitä vähemmän jäännösvetyä on, sitä vähemmän hapan se on.
Esimerkiksi fosforihappo, H3Poikki4, Natriumista voidaan saada enintään kaksi happasuolaa. Nämä ovat: nah2Poikki4 (NA+ Korvaa vety, joka vastaa H: tä+) ja na2HPO4.
Voi palvella sinua: Seleeni: historia, ominaisuudet, rakenne, hankkiminen, käyttöPerinteisen nimikkeistön mukaan nämä suolat on nimetty sekä oksisalit (täysin suojaamaton), mutta ennen sanaa "happo" metallin nimeen. Siten Nah2Poikki4 Se olisi natriumvesifosfaatti ja NA2HPO4 Natriumhappofosfaatti (koska sillä on h: lla.
Toisaalta varaston nimikkeistö käyttää mieluummin sanaa 'vety', joka 'happo'. Nah2Poikki4 Se olisi natriumidihydra ja na2HPO4 Vety natriumfosfaatti. Huomaa, että näillä suoloilla on neljä atomia: Na, H, P ja O.
Perusoksit
Perusoksisalit ovat ne, jotka sisältävät anionin OH koostumuksessaan-. Esimerkiksi, harkitse suolakanoa3Voi (ca2+ EI3- vai niin--A. Nimetäkseen se riittää antamaan sana 'perus' metallin nimelle. Siten hänen nimensä olisi: kalsiumin perusnitraatti. Ja entä cuio3vai niin? Hänen nimensä olisi: Cupric Basic Yodato (Cu2+ Io3- vai niin--A.
Varaston nimikkeistön mukaan sana 'perus' korvataan hydroksidilla, jota seuraa käsikirjoituksen käyttö ennen oksoanion nimeä.
Aikaisemmat esimerkit toistetaan niiden nimet olisivat jokaiselle: kalsiumhydroksiditraatti ja kuparihydroksidi-andodaatti (II); Muistaen, että metalli Valencia on ilmoitettava suluissa ja roomalaisten lukujen kanssa.
Kaksoisuolat
Kaksosuoloissa on kaksi erilaista kationia, jotka ovat vuorovaikutuksessa samantyyppisen anionin kanssa. Oletetaan, että kaksinkertainen suola: Cu3Usko (PO4-A3 (Cu2+ Usko3+ Poikki43--A. Se on rauta- ja kuparifosfaatti, mutta sopivin nimi tähän on: kolminkertainen kupari (II) ja rauta (iii) fosfaatti.
Kosteutetut suolat
Nämä ovat hydraatteja, ja ainoa ero on, että niiden nimien lopussa vesimuotojen lukumäärä on määritelty. Esimerkiksi MNCL2 Se on mangaanikloridi (II).
Voi palvella sinua: bentsoiini: rakenne, ominaisuudet, käytöt ja riskitHänen hydraatinsa, mncl2· 4H2O sitä kutsutaan mangaanikloridiksi (ii) tetrahydraatiksi. Huomaa, että atomeja on neljä: Mn, Cl, H ja O.
Kuuluisa kaksinkertainen ja hydratoitu suola on mohr, usko (NH4-A2(SW4-A2· 6H2JOMPIKUMPI. Hänen nimensä on: kaksinkertainen rautasulfaatti (II) ja heksahydraatti -ammonium.
Koulutus
Keskittymällä jälleen epäorgaanisiin kvaternäärisiin yhdisteisiin, meillä on enimmäkseen osittaisia neutralaatioita. Jos näitä esiintyy useiden metallioksidien läsnä ollessa, kaksoissuolat ovat todennäköisiä; Ja jos väliaine on hyvin emäksinen, perusoksisalit saostuvat.
Ja jos toisaalta vesimolekyyleillä on affiniteetti metalliin, ne koordinoivat suoraan sen kanssa tai ympäröivien ionien kanssa muodostaen hydraatit.
Seosten sivulla neljä erilaista metallia tai metalloidia on hitsata kondensaattorien, puolijohteiden tai transistorien valmistukseen.
Esimerkit
Lopuksi luettelo, jossa on erilaisia esimerkkejä kvaternääreistä yhdisteistä. Lukija voi käyttää sitä testatakseen nimikkeistönsä:
- PBCO3(VAI NIIN)2
- Cr (HSO4-A3
- Nahco3
- Znioh
- Cu2(VAI NIIN)2Sw3
- Li2Kaso4
- Cuso4· 5H2JOMPIKUMPI
- Agau (niin4-A2
- Kotelo4· 2h2JOMPIKUMPI
- FECL3· 6H2JOMPIKUMPI
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Epäorgaaninen nimikkeistö ja formulaatio. [PDF]. Haettu: Resurssit.koulutus.On
- Erika thalîa hyvä. (2019). Kaksoissuolat. Akatemia. Toipunut: Akatemia.Edu
- Wikipedia. (2019). Kvaternäärinen ammoniumkation. Haettu: vuonna.Wikipedia.org

