Kemiallinen pitoisuus

- 1688
- 282
- Mr. Clifford Kshlerin
 Kemiallinen konsentraatio määrittää liuenneen aineen ja liuottimen osuuden kemiallisessa liuoksessa
Kemiallinen konsentraatio määrittää liuenneen aineen ja liuottimen osuuden kemiallisessa liuoksessa Mikä on kemiallinen pitoisuus?
Se Kemiallinen pitoisuus Se on ratkaisujen ominaisuus, joka edustaa liuenneen aineen määrää jokaiselle ratkaisuyksikölle. Toisin sanoen, se on luku, joka osoittaa osuuden, jossa liuenneen aineen ja liuottimen sijaitsevat.
Muista, että liuos on homogeeninen seos, jonka muodostuu liuotin (yleensä neste) ja yksi tai useampi aine liuenneena liuottimeen, jota kutsumme liuenneiksi aineiksi. Liuosille on ominaista liuotin, liuenneen aineen ja pitoisuuden.
Keskittyminen on erittäin hyödyllinen ominaisuusominaisuus, koska se antaa meille mahdollisuuden kuvata niitä. Esimerkiksi, jos tiedämme, että suolan pitoisuus merivedessä on 35 grammaa jokaiselle litralle, niin tiedämme, että talossamme liuotamme 35 grammaa suolaa litraa liuosta, saamme yhtä suuren suolaisen liuoksen meriveden.
Kemiallisen pitoisuuden ominaisuudet
Se on intensiivinen omaisuus
Tämä on keskittymisen pääpiirte. Intensiivinen tarkoittaa, että se ei riipu ratkaisun määrästä. Esimerkiksi tämä tarkoittaa, että pitoisuus on sama meriveden tippaan kuin 100 litrassa.
Voi vaihdella lämpötilan mukaan
Yleensä nesteet laajentavat tai lisäävät niiden tilavuutta lämmittäessä. Tämä pätee myös ratkaisuihin. Tästä syystä ilmaistut pitoisuudet voivat muuttua hiukan lämmitettäessä tai jäähdytettäessä liuosta.
Se voi kattaa erittäin laajan valikoiman
Riippumatta yksiköistä, joissa kemiallinen pitoisuus ilmaistaan, sillä voi olla suhteellisen suurista arvoista erittäin pieniin arvoihin.
Esimerkiksi prosentteina ilmaistun liuoksen pitoisuuksilla voi olla arvoja 0% - 100%, mikä kattaa monet suuruusluokat. Voisimme valmistaa 90%: n ratkaisun, koska voimme myös valmistaa yhden 10-12%, joka on lähes 14 pienen suuruuden järjestystä.
Mikä on kemiallinen pitoisuus?
Liuoksen pitoisuuden tunteminen antaa meille mahdollisuuden kuvata sitä. Ratkaisuissa on monia ominaisuuksia, jotka riippuvat niiden pitoisuudesta. Esimerkiksi sulamis- ja kiehumispiste riippuu pitoisuudesta, joten tietäen, että se antaa meille mahdollisuuden laskea nämä kaksi ominaisuutta.
Voi palvella sinua: lasimainen tilaToisaalta keskittyminen antaa meille mahdollisuuden verrata ratkaisua helposti toiseen. Jos meillä on kaksi vesiliuotetta sokerilla, niiden pitoisuuksien tietäminen antaa meille tietää, mikä kahdesta on makeampaa.
Lisäksi kaikki mahdolliset kemialliset reaktiot riippuvat voimakkaasti loputtomien liuenneiden aineiden pitoisuudesta soluissa ja elävien olentojen ympäristössä.
Esimerkiksi hapen pitoisuus ilmassa määrittää, tukehtuuiko henkilö vai ei; Liuoksen pH (joka on tapa mitata H -ionien pitoisuus+) Selvittää, elävätkö bakteerit ja lisääntyvätkö vai päinvastoin, se kuolee; ja myrkkyn pitoisuus määrittää, onko se tappava vai ei.
Pitoisuusyksiköiden tyypit
Liuoksen pitoisuus on yksi, joten ei ole oikein puhua pitoisuustyypeistä. Sama pitoisuus voidaan kuitenkin ilmaista erityyppisissä pitoisuuksissa. Nämä ovat:
- Fysikaaliset keskittymisyksiköt
- Kemialliset pitoisuusyksiköt
Fysikaaliset keskittymisyksiköt
Näille on ominaista ilmaista liuenneen aineen ja liuottimen määrät joko massa- tai tilavuusyksiköissä. Niitä kutsutaan fyysisiksi yksiköiksi, koska ne liittyvät massoihin ja tilavuuksiin moolien ja vastaavan sijasta.
Kun verrataan kahta ratkaisua, joilla on sama fysikaalinen pitoisuus, emme voi varmistaa, että niillä on yhtä suuret määrät atomeja ja molekyylejä. Tämä erottaa ne kemiallisista pitoisuuksista.
Yleisimmät fysikaaliset keskittymisyksiköt ovat:
- Yksinkertainen otsikko (TS)
- %paino/paino (%p/p) tai massa/massa (%m/m)
- %paino/tilavuus (%P/V) tai massa/tilavuus (%m/v)
- % tilavuus/tilavuus (% tilavuus/tilavuus)
- Osat miljoona painoa/painoa (ppmp/p) tai massa/massa (ppmm/m-A
- Osat miljoona painoa/tilavuus (ppmP/V) tai massa/tilavuus (ppmm/v-A
- Osat miljoonaa määrää/tilavuus (ppmV/v-A
Kemialliset pitoisuusyksiköt
Kemiallisten yksiköiden tapauksessa liuenneen aineen ja joissain tapauksissa liuottimen tai liuoksen määrä ilmaistaan liuoksessa olevien hiukkasten tai moolien tai ekvivalenttien lukumäärän perusteella.
Niitä kutsutaan kemiallisiksi yksiköiksi, koska kahdella liuoksella, joilla on sama kemiallinen pitoisuus.
Voi palvella sinua: Liukoisuussäännöt: Yleiset näkökohdat ja säännötYleisimmät kemialliset yksiköt ovat:
- Molaarisuus (M)
- Molaisuus (M)
- Molaarinen fraktio (x)
- Normaali (n)
Fyysisten pitoisuusyksiköiden kaava
Yksinkertainen otsikko (TS)
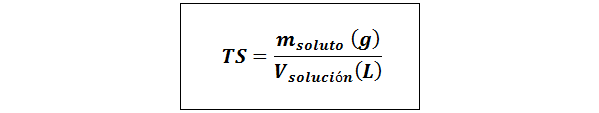
Missä mliuennut edustaa liuenneen aineen massaa grammissa ja Vratkaisu Se on liuoksen tilavuus litrana.
%paino/paino (%p/p) tai massa/massa (%m/m)
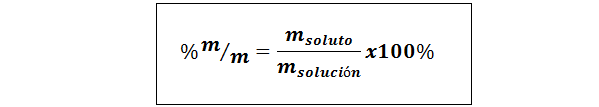
Missä mliuennut ja mratkaisu Edusta vastaavasti liuenneen aineen ja liuoksen massan. Mitä tahansa massayksikköä voidaan käyttää (g, mg, kg jne.), niin kauan kuin molemmat massot ilmaistaan samassa yksikössä.
%paino/tilavuus (%P/V) tai massa/tilavuus (%m/v)
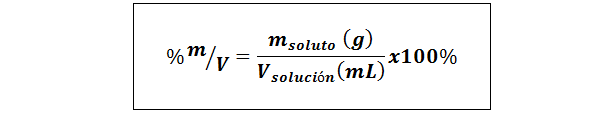
Missä mliuennut Se on liuoksen massa grammissa ja Vratkaisu Se on liuoksen tilavuus, tässä tapauksessa millilitrissä.
% tilavuus/tilavuus (% tilavuus/tilavuus)

Missä vliuennut ja vratkaisu edustavat vastaavasti liuenneen aineen ja liuoksen tilavuutta. Tässä tapauksessa mitä tahansa yksikköä voidaan käyttää näiden tilavuuksien ilmaisemiseen, kunhan se on sama molemmille.
Osat miljoona painoa/painoa (ppmp/p) tai massa/massa (ppmm/m-A
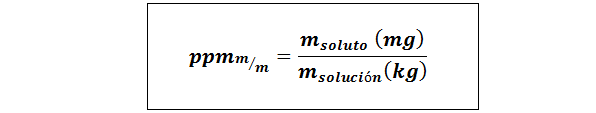
Missä mliuennut ja mratkaisu Ne edustavat liuenneen aineen massaa ja liuosta milligrammissa ja kilogrammissa.
Osat miljoona painoa/tilavuus (ppmP/V) tai massa/tilavuus (ppmm/v-A
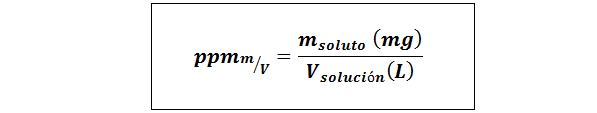
Missä mliuennut Se on liuoksen massa milligrammissa ja Vratkaisu Se on liuoksen tilavuus, tässä tapauksessa litrassa.
Osat miljoonaa määrää/tilavuus (ppmV/v-A
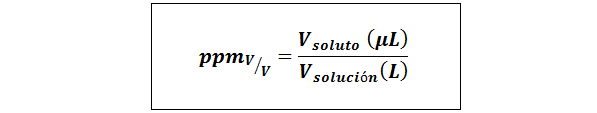
Missä vliuennut ja vratkaisu Ne ovat liuenneen aineen tilavuus ja liuos mikrolitroilla ja litroilla.
Kemiallisten pitoisuusyksiköiden kaavat
Kemiallisten pitoisuusyksiköiden tapauksessa liuoksen komponenttien määrä, erityisesti liuenneen aineen, ilmaistaan joko moolien lukumäärässä tai vastaavien lukumäärässä. Näissä määrissä on todellinen hiukkasten lukumäärä (atomit, molekyylit tai ionit, tapauksen mukaan).
Näitä määriä ei voida tietää pelkästään punnitsemalla tai mittaamalla aineiden tilavuus, mutta yhdisteiden koostumus tai kemiallinen kaava on tarpeen pitoisuuden määrittämiseksi. Tämä on tärkein syy siihen, miksi niitä kutsutaan kemiallisiksi pitoisuuksiksi.
Seuraavaksi esitetään erilaiset kaavat neljän yleisimmin käytetyn kemiallisen pitoisuuden laskemiseksi:
Molaarisuus (M)
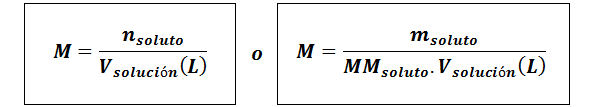
Missäliuennut Ne ovat liuenneen aineen moolialiuennut edustaa liuenneen aineen massaa grammissa, mmliuennut on sen molaarinen massa ja vratkaisu Se on liuoksen tilavuus litrana.
Molaisuus (M)
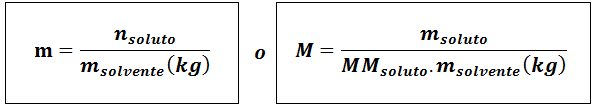
Missäliuennut Ne ovat liuenneen aineen moolialiuennut edustaa liuenneen aineen massaa grammissa, mmliuennut Se on sen molaarinen massa ja mliuotin Se on liuottimen massa kilogrammissa.
Voi palvella sinua: SolvaatioMolaarinen fraktio (x)
Molaarinen fraktio voidaan laskea sekä liuenneen että liuottimen suhteen. Liuenneen aineen molaarinen osuus on:
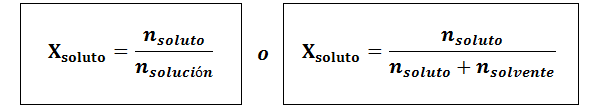
Liuotin on:
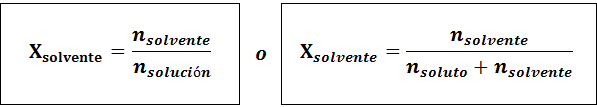
Molempien molaaristen fraktioiden välinen suhde on:
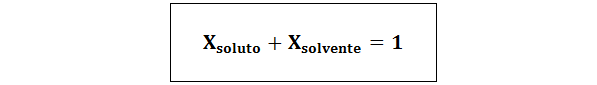
Kaikissa tapauksissa nliuennut, nratkaisu ja nliuotin ovat vastaavasti liuenneen aineen, liuoksen ja liuottimen moolit.
Normaali (n)
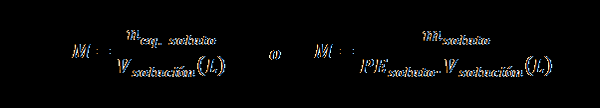
Täällä nEq. liuennut edustaa liuenneen aineen vastaavan lukumäärää, Mliuennut edustaa liuenneen aineen massaa, PEliuennut Se on liuenneen aineen vastaava paino ja vratkaisu Se on liuoksen tilavuus litrana.
Kemialliset pitoisuusesimerkit
- Suolan pitoisuus merivedessä on 35 g/l, mikä vastaa molaarisuutta 0,60 mol/l.
- Keskimääräinen verensokeripitoisuus on välillä 82 mg/dl - 110 mg/dl. Nämä pitoisuudet vastaavat yksinkertaista otsikkoa nopeudella 0,82 g/l ja 1,10 g/l ja molaarisuudessa 4,4: ssä.10-3 mol/l ja 6,1.10-3 Mol/L, vastaavasti.
- Ilmaa voidaan pitää kaasumaisena liuoksena, joka muodostaa pääasiassa typen ja hapen, liuotin on typpi, koska se on suurempi osuus. Tämä kaasuliuos sisältää 0,22 happi- ja typpifraktion, joka on noin 0,78.
- Teräs on seos raudan ja hiilen välillä. Vaikka ne eivät ole tiukasti liuoksia, nämä ovat homogeenisia kiinteitä seoksia, jotka yleensä sisältävät hiilipitoisuuden luokkaa 0,03% ja 1 075% massassa.
- Huolimatta ympäristölle ja ihmisten terveydelle sen tuhoisista vaikutuksista, monien epäpuhtauksien pitoisuudet ovat yleensä huomattavasti alhaisia. Esimerkki on arseenin myrkyllisen metallin suurin pitoisuus vedessä. Maailman terveysjärjestö (WHO) totesi, että juomaveden ei tulisi sisältää yli 10 ppb m/v (osaa miljardia tai nanogrammia litrassa). Tämä pitoisuus vastaa 0.010 ppm m/v.
Viitteet
- BBC (S. F.-A. Liuosten pitoisuus - Laskelmat kemiassa - AQA - GCSE Chemistry (Single Science) Review - AQA. BBC otettu.yhteistyö.Yhdistynyt kuningaskunta.
- Tässä on mitä pitoisuus tarkoittaa kemiassa (2020). Poistetaan Thidscosta.com.
- LibretTexts (2022). 4.5: Ratkaisujen pitoisuus. Otettu kemista.Librettexts.org.
- Mandal, a., MD. (2021). Normaalit verensokeriarvot. Otettu uutislääketieteellisestä.netto.
- Kemikaalit.S. F.-A. Kemialliset pitoisuudet. Otettu kemioista.netto.

