Galvaaniset korroosiomekanismit, esimerkit, suojaus

- 3714
- 666
- Louis Moen
Se Galvaaninen tai sähkökemiallinen korroosio Se on prosessi, jolla metalli tai seos hajotetaan verrattuna verrattuna sen tavanomaiseen hapettumiseen. Voidaan sanoa, että se on kiihtynyt hapettuminen ja jopa tarkoituksella; kuten paristoissa tai paristoissa.
Tämä tapahtuu sarjan olosuhteissa. Ensinnäkin on oltava aktiivinen metalli, nimeltään anodi. Lisäksi ja toiseksi on oltava pieni reaktiivinen jalo -metalli, nimeltään katodi. Kolmas ja neljäs olosuhteet ovat elatusaineen läsnäolo, jossa elektronit leviävät, kuten vesi ja ioniset tai elektrolyyttejä.
 Hapettunut rauta kruunu. Lähde: Pixnio.
Hapettunut rauta kruunu. Lähde: Pixnio. Galvaaninen korroosio on havaittavissa etenkin meriympäristöissä tai rannoilla. Ilmavirrat nostavat vesihöyryn massoja, jotka puolestaan vetävät joitain ioneja; Jälkimmäinen päätyy tarttumaan ohuen vettä tai tippoja, jotka lepäävät metallipinnalla.
Nämä kosteuden ja suolapitoisuuden olosuhteet suosivat metallikorroosiota. Eli ylemmän kuvan kaltainen rauta kruunu hapettuu nopeammin, jos se altistuu lähellä olevalle merelle.
Helppo, jonka metalli on hapettua toiseen verrattuna, voidaan mitata kvantitatiivisesti sen pelkistyspotentiaalien kautta; Kemiakirjoissa on runsaasti pöytiä, joissa on nämä potentiaalit ja. Mitä negatiivisempi, sitä suurempi taipumus hapettua.
Lisäksi, jos tämä metalli on toisen läsnäollessa, jolla on erittäin positiivinen pelkistyspotentiaali, sillä sillä on suuri AE, reaktiivisen metallin hapettuminen on aggressiivisempaa. Muut tekijät, kuten pH, ioninen voima, kosteus, hapen esiintyminen ja hapettuneiden metallin alueiden välinen suhde.
[TOC]
Mekanismit
Käsitteet ja reaktiot
Ennen galvaanisen korroosion taustalla olevien mekanismien käsittelyä tietyt käsitteet on selvennettävä.
Reaktiossa rédox laji menettää elektroneja (hapettunut), kun taas toinen voittaa ne (se on vähentynyt). Elektrodia, jolla hapettumista tapahtuu, kutsutaan anodiksi; Ja jossa vähennys tapahtuu, katodi (englanniksi nemonista sääntöä käytetään yleensä Redcat muistaa).
Siten elektrodille (yksiosainen, ruuvi jne.) Metalli m, jos tämä hapettuu, sanotaan, että se on anodi:
M => mn+ + NE-
Vapautuneiden elektronien lukumäärä on yhtä suuri kuin kationin m: n positiivisen kuormituksen suuruusn+ seurauksena oleva.
Sitten toisen elektrodin tai metallin (molempien metallien on oltava jollain tavalla kosketuksessa), vastaanottaa vapautetut elektronit; Mutta tämä ei kärsi kemiallisesta reaktiosta, jos ne saavat elektroneja, koska se vain johtaisi niitä (sähkövirta).
Siksi liuoksessa on oltava toinen laji, jonka nämä elektronit voivat muodollisesti hyväksyä; Esimerkiksi niin helppo vähentää metalli -ioneja:
Voi palvella sinua: Epäselvä järjestelmäR -n+ + NE- => R
Toisin sanoen muodostuu metallikerros r ja elektrodi tulee raskaammaksi; Vaikka metalli m menettäisi massaa, koska niiden atomit liukenevat.
Depolarisaattorit
Ja jos ei olisi metallikationeja, joita voitaisiin vähentää riittävästi? Tällöin muut keskellä olevat lajit vievät elektroneja: depolarizadores. Nämä liittyvät läheisesti pH: een: o2, H+, vai niin- ja h2JOMPIKUMPI.
Happi- ja vesivahvistuksen elektronit reaktiossa, joka ilmenee seuraavalla kemiallisella yhtälöllä:
JOMPIKUMPI2 + 2H2O + 4e- => 4OH-
Kun taas iones h+ Ne muuttuvat h2-
2H+ + 2e- => H2
Eli OH -lajit- ja h2 Ne ovat yleisiä galvaanisten tai sähkökemiallisten korroosioiden tuotteita.
Vaikka metalli R ei osallistu mihinkään reaktioon, se on jalo, joka M edistää sen hapettumista; Ja näin ollen, OH -ioneja tuotetaan suurempi tuotanto- o vetykaasu. Koska loppujen lopuksi on ero pelkistyspotentiaalien, ΔE, yksi näiden prosessien päämoottoreista.
Rautakorroosio
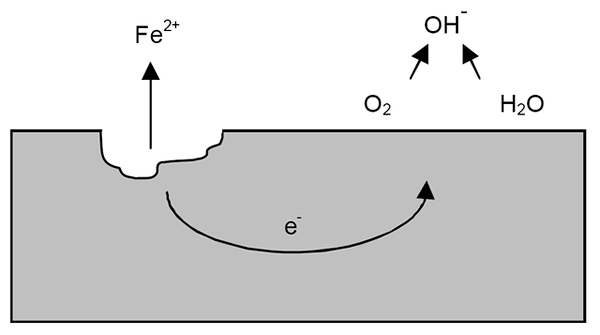 Raudan korroosiomekanismi. Lähde: Wikipedia.
Raudan korroosiomekanismi. Lähde: Wikipedia. Edellisten selvennyksien jälkeen esimerkki raudan korroosiosta (ylivoimainen kuva) voidaan osoittaa. Oletetaan, että on ohut vettä, johon happi liukenee. Ilman muiden metallien läsnäoloa, depolarisoorit merkitsevät reaktioohjeet.
Siten rauta menettää joitain atomeja sen pinnalla liuottaakseen veteen uskon kationeina2+-
Fe => usko2+ + 2e-
Nämä kaksi elektronia kulkevat rautakappaleen hyväksi sähköjohtimeksi. Niin, että tiedetään, missä hapettuminen tai anodinen paikka alkoi; Mutta ei missä katodisen alueen vähentäminen tai sijainti jatkuu. Katodinen paikka voi olla missä tahansa; Ja mitä korkeampi sen mahdollinen alue, mikä pahempaa on metallin korroosio.
Oletetaan, että elektronit saavuttavat pisteen, kuten ylemmässä kuvassa esitetään. Siellä sekä happi että vesi kärsivät jo kuvattusta reaktiosta, jolla OH vapautuu-. Nämä anionit Voi- He voivat reagoida uskon kanssa2+ Muodostaa uskon (OH)2, joka saostuu ja kärsii myöhemmät hapettimet, jotka lopulta muuttavat sen ruosteeksi.
Sillä välin anodinen sivusto halkeilee yhä enemmän.
Esimerkit
Jokapäiväisessä elämässä esimerkkejä galvaanisista korroosioista on lukuisia. Meidän ei tarvitse viitata raudan kruunuun: kaikki metalleista tehdyt esineet voivat kärsiä samasta prosessista märän ja suolaliuoksen ympäristössä läsnäolossa.
Voi palvella sinua: fosfaattiryhmäRannan lisäksi talvi voi myös vaikuttaa ihanteellisiin korroosioolosuhteisiin; Esimerkiksi, kun heität suoloja tien lumelle estääksesi autoja luistelusta.
Fyysisestä näkökulmasta kahden metallin hitsatuissa ammattiliittoissa se voi säilyttää kosteuden, aktiiviset korroosiokohdat. Tämä johtuu siitä, että molemmat metallit käyttäytyvät kuin kaksi elektrodia, ja reaktiivisin menettää elektronit.
Jos OH -ionin tuotanto- Se on huomattavaa, voit jopa ajaa auton maalin tai kyseisen esineen.
Anodiset indeksit
Voidaan rakentaa omia esimerkkejä galvaanisista korroosioista pelkistyspotentiaalitaulukoiden avulla. Anodinen hakemistotaulukko (yksinkertaistettu itsessään) valitaan kuitenkin havainnollistamaan tätä asiaa.
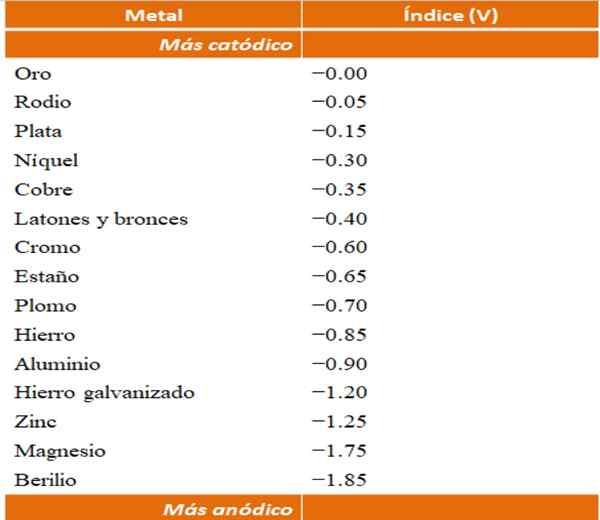 Anodiset indeksit eri metalleille tai seoksille. Lähde: Wikipedia.
Anodiset indeksit eri metalleille tai seoksille. Lähde: Wikipedia. Oletetaan esimerkiksi, että haluaisimme rakentaa sähkökemiallisen solun. Metallit, jotka ovat anodisen indeksin taulukon yläosa, ovat enemmän katodia; toisin sanoen niitä vähenee helposti, ja siksi niitä on vaikea saada ne liuoksessa. Kun taas alareunassa olevat metallit ovat anodisempia tai reagensseja, ja se ajaa helposti.
Jos valitsemme kultaa ja berylliumia, molemmat metallit eivät voineet olla yhdessä pitkään, koska beryllium hapettaisi äärimmäisen nopean.
Ja jos päinvastoin, meillä on Ag -ioniratkaisu+ Ja me upotamme alumiinipalkin siihen, se liukenee samaan aikaan, kun saostuu metallihopeahiukkasista. Jos tämä palkki liittyy grafiittielektrodiin, elektronit kulkevat siihen sähkökemiallisesti hopean tallettamiseen kuin hopeakalvo.
Ja jos alumiinipalkin sijasta on kuparista, liuoksesta tulee sinertävä ionien läsnäolon avulla2+ vedessä.
Suoja sähkökemialliselta korroosiolta
Uhrauspinnoitteet
Oletetaan. Helpoin vaihtoehto olisi lisätä magnesiumia, joka peittäisi sinkin niin, että hapettumisen jälkeen magnesiumista vapautuvat elektronit vähentävät Zn -kationeja2+ takaisin.
MGO: n sinkkiä koskeva elokuva ennemmin kuin myöhemmin päätyisi halkeiluun, joka tarjoaa korkean vaenan nykyisen sivuston; toisin sanoen sinkkikorroosio kiihtyy voimakkaasti näissä kohdissa.
Tätä sähkökemiallista korroosiota koskevaa suojaustekniikkaa tunnetaan uhrauksen verhouksen käyttöä. Tunnetuin on sinkki, jota käytetään kuuluisassa tekniikassa nimeltään galvanisaatio. Niissä metalli M on peitetty, erityisesti rauta, sinkki (usko/Zn).
Voi palvella sinua: Fenolphthalein (C20H14O4)Jälleen sinkki hapettuu ja sen oksidi peittää raudan ja välittää elektroneja, jotka vähentävät uskoa2+ Se voidaan muodostaa.
Jalo pinnoitteet
Oletetaan jälleen, että haluat suojata samaa sinkkiarkkia, mutta nyt kromia käytetään magnesiumin sijasta. Kromi on jaloampi (katodisempi, katso anodisen indeksin taulukko) kuin sinkki, ja siksi se toimii jaloina pinnoitteena.
Tämän tyyppisen pinnoitteen ongelmana on, että kun se halkeilee, se edistää ja nopeuttaa edelleen alla olevan metallin hapettumista; Tässä tapauksessa sinkki syöpistyy jopa enemmän kuin peittää magnesiumin.
Ja lopuksi, on muita pinnoitteita, jotka koostuvat maalauksista, muovista, antioksidanteista, rasvoista, hartsista jne.
Lastenkoe
Rautalevy kuparisuoloissa
Samasta anodisen indeksin taulukosta voidaan suunnitella yksinkertainen koe. Kohtuullisen määrän (alle 10 gramman) liuottaminen cuso4· 5H2Tai vedessä lasta pyydetään uppoutumaan kiillotetulle rautalevylle. Valokuva on otettu ja prosessin sallitaan kehittyä muutaman viikon ajan.
Liukeneminen on alun perin sinertävää, mutta se alkaa menettää väriä, kun taas rautalevy saa kuparin värin. Tämä johtuu siitä, että kupari on jalo kuin rauta, ja siksi sen kationit cu2+ Ne pelkistetään metallisiksi kupariksi ioneista, jotka on määritelty raudan hapettumisella:
Fe => usko2+ + 2e-
Cu2+ + 2e- => Cu
Hopeaoksidin puhdistus
Hopeaobjektit mustautuvat ajan myötä, varsinkin jos ne ovat kosketuksissa rikkiyhdisteiden lähteen kanssa. Sen oksidi voidaan poistaa, jos esine upotetaan vesiputkeen natriumbikarbonaatin ja alumiinikalvon kanssa. Bikarbonaatti tarjoaa elektrolyyttejä, jotka helpottavat elektronien kuljetusta esineen ja alumiinin välillä.
Seurauksena on, että lapsi voi arvostaa, että esine menettää mustat täplät ja loistaa ominaisella hopeavärillä; Kun taas alumiinifolio juoksee, kunnes katoaa.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2019). Galvaaninen korroosio. Haettu: vuonna.Wikipedia.org
- Stephen Lower. (16. kesäkuuta 2019). Elektokemiallinen korroosio. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Avoin yliopisto. (2018). 2.4 Korroosioprosessi: Galvaaninen korroosio. Palautettu: Avoin.Edu
- Asiakkaan tekninen palvelu Brush Wellman Inc. (S.F.-A. Opas galvaaniseen korroosioon. Harja Wellman -suunnitellut materiaalit.
- Giorgio Carboni. (1998). Elektokemian kokeet. Haettu osoitteesta: fensci.com
- « Sofistinen relativismi alkuperän, ominaispiirteet, esimerkit
- Sykliset hiilivetyrakenne, ominaisuudet, esimerkit »

