Mikä on elektronegatiivisin elementti ja miksi?

- 2050
- 580
- Kelly Kilback
 Elektronegatiivisin elementti on fluori (F), lukittu punaiseen ympyrään
Elektronegatiivisin elementti on fluori (F), lukittu punaiseen ympyrään Hän Lisää elektronegatiivista elementtiä Jaksollisessa taulukossa se on fluori, jonka kemikaali on f ja kuuluu halogeeniryhmään. Katkaisun taulukon kaikkien elementtien joukossa fluori on innokkain vangitsemaan elektroneja muista atomeista.
Tämä elementti, kaasumainen huoneenlämpötilassa, on erittäin reaktiivinen, ja siksi sitä ei ole helppo löytää puhtaasta tilasta luonnossa. Fluori yhdistyy helposti muihin elementteihin, kuten rikki, kalsium ja metallit, samoin kuin lukuisiin yhdisteisiin, etenkin vetyä sisältäviin yhdisteisiin.
Sen korkea elektronegatiivisuus antaa sinun jopa yhdistää jalokaasuihin, kuten ksenoniin, Kriptoniin ja radoniin.
Fluorin jälkeen happi on toinen elementti, jolla on korkein elektronegatiivisuus. Sitä vastoin pienimmän elektronegatiivisuuden elementit ovat Francio (FR) ja Cesium (CS).
 Koska se on elektronegatiivisin elementti, fluori muodostaa lukuisia yhdisteitä, kuten fluoriitti tai kalsiumfluori. Lähde: Wikimedia Commons
Koska se on elektronegatiivisin elementti, fluori muodostaa lukuisia yhdisteitä, kuten fluoriitti tai kalsiumfluori. Lähde: Wikimedia Commons Nämä ovat siksi eniten elektropositiivinen Se on olemassa, vaikka Francio on radioaktiivinen ja luonteeltaan hyvin vähän runsaasti.
Elektronegatiivisuus ja jaksollinen taulukko
Kemisti ja palkinto Nobel Linus Pauling (1901-1994) kehitti elektronegatiivisuuden laajuuden, vaikka käsite johtuu ruotsalaisesta kemististä Jöns Jahins Jakob Berzelius (1779-1848).
Pauling -asteikkoa, joka määrittää ulottuvuuden numeeriset arvot elektronegatiivisuudelle, käytetään mittaamaan intensiteetti, jolla atomi houkuttelee toisen eri atomin elektronia, ja siten muodostavat linkit.
Jokaisella elementillä on oma elektronegatiivisuus, joka riippuu sen atomiominaisuuksista. Se määritetään kokeellisesti ja epäsuorasti, esimerkiksi linkkienergian mittaus, kuten Pauling teki noin vuonna 1932.
Paulingin elektronegativiteettiasteikolla fluori on ensin, likimääräinen arvo 3.98 ≈ 4.0 -.
Voi palvella sinua: alifaattiset hiilivedyt: ominaisuudet, nimikkeistö, reaktiot, tyypitElektronegatiivisuus on elementtien säännöllinen ominaisuus. Useimmissa tapauksissa (on joitain poikkeuksia), havaitaan, että elektronegatiivisuus kasvaa siirtyessään vasemmalta oikealle jakson taulukon rivien läpi.
Ja myös nouse alhaalta ylöspäin siirtämällä sarakkeessa.
 Pauling -asteikon mukainen elektronegativiteettitaulukko. Fluori on elektronegatiivisin elementti, joka sijaitsee oikealla ja oikealla puolella, kun taas Francio on kaikkien vähiten elektronegatiivinen tai elektropositiivisin, jos se on edullinen, ja on vasemmassa ja alas pylväässä. Lähde: f. Zapata.
Pauling -asteikon mukainen elektronegativiteettitaulukko. Fluori on elektronegatiivisin elementti, joka sijaitsee oikealla ja oikealla puolella, kun taas Francio on kaikkien vähiten elektronegatiivinen tai elektropositiivisin, jos se on edullinen, ja on vasemmassa ja alas pylväässä. Lähde: f. Zapata. Fluorielektronegatiivisuus
Syy siihen, että fluori on elektronegatiivisin elementti jaksollisessa taulukossa, johtuu sen elektronisesta kokoonpanosta (tapa, jolla sen elektronit on järjestetty ytimen ympärille).
Tämä kokoonpano on 1s22s22 p5, Joten fluoridissa on 5 elektronia sen uloimmassa kerroksessa.
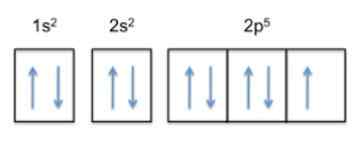
Nyt, koska atomin trendi on suorittaa ulkoreuna, se tarkoittaa, että fluori hyväksyy muiden atomien elektronin erittäin helposti, jotta saadaan stabiilisuus ja muistuttaa saman rivin jalokaasua, joka on neon , jonka sähköinen kokoonpano on 1s22s22 p6.
Fluoriatomilla on hyvin pieni säde, koska niiden ytimen protonit houkuttelevat elektroneja erittäin voimakkaasti pitäen ne lähempänä kuin vähemmän elektronegatiivisten elementtien atomeja, kuten cessium ja francio.
Siksi jälkimmäiset ovat valmiita luopumaan elektroneista helposti linkkien muodostamiseksi.
Viitteet
- Aguilar, c. Kemiallisen oppimisyksikön opas I. Haettu: IPN.MX.
- Atkins, p. (2005). Kemian periaatteet, löytöpolut. Kolmas. Painos. Pan -american lääketieteellinen toimitus.
- Clark, J. Elektronegoniteetti. Palautettu: Chem.Librettexts.org.
- Hein, m. (2014). Korkeakoulukemian perusteet. 14. ed. Viiva.
- Lentech. Kemialliset elementit, jotka on tilattu sen elektronegatiivisuudella. Toipunut: lentech.On.

