Kemiallinen sidos
- 4147
- 957
- Gustavo Runte DVM
Selitämme, mitkä ovat kemialliset linkit, tyypit, jotka ovat olemassa, ja annamme monia esimerkkejä
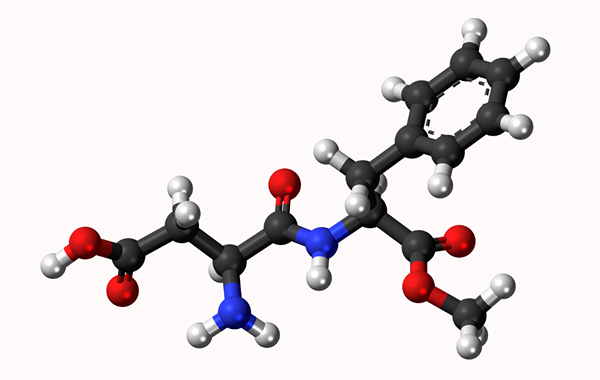
 Aspartamo -molekyylimalli: Yksinkertainen linkki, jota edustaa viiva ja kaksoissidos kahdella rivillä. Pallot ovat atomeja
Aspartamo -molekyylimalli: Yksinkertainen linkki, jota edustaa viiva ja kaksoissidos kahdella rivillä. Pallot ovat atomeja Mikä on kemiallinen sidos?
Eräs Kemiallinen sidos Se on voima, joka pitää yhdessä yhdisteen atomien kanssa. Atomien yhdistävä voima on sähkömagneettinen, ja kun atomit ovat sitoutuneet, ne säilyttävät oman luonteensa.
Esimerkiksi yhteinen vesi muodostuu kahden vetyatomin liiton vuoksi (H2) ja yksi happea (O); Siksi sen kemiallinen kaava on H2JOMPIKUMPI. Vaikka vetyatomit ovat yhdistyneitä veden muodostamiseksi, vetyatomit ovat vety ja happi on edelleen happea.
Muista, että atomit muodostuvat ytimellä, jota ympäröi elektronipilvi, joilla on negatiivinen kuorma. Atomin ytimellä on positiivinen varaus, joka onnistuu houkuttelemaan elektroneja.
Elektroneja houkuttelee kuitenkin myös muiden atomien ytimiä. Näin kemialliset yhteydet muodostuvat. Se tosiasia, että atomit tuottavat tai jakavat elektroneja, tuottaa erityyppisiä kemiallisia linkkejä.
Kemiallisissa sidoksissa atomit saavat, voittavat tai jakavat elektroneja niin kutsutusta Valencia -kerroksesta, joka on atomin uloin kerros, jossa reaktiivisuus tapahtuu tai taipumus muodostaa kemiallisia sidoksia.
Nämä linkit tekevät uusia aineita (ei seoksia), joita ei voida erottaa tekniikoiden, kuten seulan tai suodattamisen avulla.
Kemialliset sidostyypit
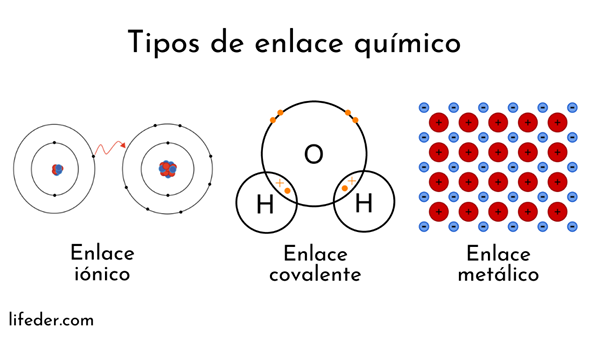
Atomit muodostuvat ytimellä (positiivisella sähkövarauksella) ja elektronilla (hiukkasilla, joilla on negatiivinen sähkövaraus), jotka pyörivät ympärillä. Molemmat osapuolet puuttuvat kemiallisiin sidoksiin.
Kemiallisia sidoksia, joihin liittyy atomi -ytimiä, kutsutaan metallisiksi. Toisaalta elektronien vaihtoa koskevat ne on jaettu ioniin ja kovalenttiseen.
Voi palvella sinua: kloorobentseeni (C6H5CL)Ionien linkit
Tämäntyyppinen linkki on erittäin kestävä; tuottaa kiinteitä kemiallisia yhdisteitä (kiteitä) vedessä ja korkealla sulamispisteellä (välillä 300 ja 1.000 astetta). Liitetyt veteen, ne ovat sähköjohtimia.
Kuinka ioniset linkit ovat?

Ionisia sidoksia tapahtuu metallin ja ei -metallin välillä, joilla on erilainen elektronegatiivisuus (kyky houkutella elektroneja). Yhden atomin Valencia -kerroksen elektronit kulkevat Valencian toiseen atomiin. Mikä on sama; Metallinen atomi antaa elektronin ei -metalliselle atomille, saavuttaen elektronisen stabiilisuuden.
Koko linkkien muodostumisprosessi -ionit (kationit ja anionit) muodostetaan, joten ioninen sidosnimi.
Esimerkki tämän tyyppisestä sidoksesta on natriumkloridi: Tämä kemiallinen yhdiste muodostuu, kun kloori (CL) houkuttelee valenssikerroksen elektronia, jolla on natriumiatomi (Na).
Toinen esimerkki on mangaanikloridi (MGC), jota käytetään maalausten ja desinfiointiaineiden valmistuksessa. Kemiallisen sidoksen seurauksena mangaaniatomin elektronit absorboivat klooriatomin avulla.
Kovalenttiset linkit
Kovalenttiset sidokset ovat erittäin kovia ja tuottavat liukenemattomat kemialliset yhdisteet, joilla on korkea fuusiolämpötila (yli 1.000 astetta). He eivät johda sähköä.
Tavan mukaan, jolla atomit jakavat elektronit, kovalenttiset sidokset voivat olla:
- Yksinkertainen: He jakavat pari elektronia (A-A).
- Kaksinkertainen: Jaa kaksi elektroniparia (a =).
- Kolminkertaistaa: Jaa kolme elektroniparia (A²).
Kuinka kovalenttisia sidoksia muodostetaan?

Kovalenttinen sidos muodostuu, kun kahdella ei -metallisella elementillä on elektroneja heidän valenssikerroksestaan.
Se voi palvella sinua: Rubidio: historia, ominaisuudet, rakenne, hankkiminen, käyttöElektronien vaihto tapahtuu aina siten, että se noudattaa Octet -lakia. Tämä on kemiallinen periaate, jonka mukaan atomin vakain kokoonpano on yksi, jossa sen uloimmassa kerroksessa on kahdeksan elektronia.
Esimerkki kovalenttisesta sidoksesta on vesi (H2JOMPIKUMPI). Vesimolekyylin luomiseksi tarvitaan kaksi yksinkertaista kovalenttisia sidoksia. Yksinkertaisessa sidoksessa vetyelektroni jaetaan hapen kanssa, ja happi jakaa elektronin vedyn kanssa.
Toinen kovalenttinen sidosesimerkki on hiilidioksidi (Co2), yksi tärkeimmistä kasvihuonevaikutuksista ja ilmastonmuutoksista. Tämän yhdisteen muodostamiseksi hiili ja happi luovat kaksi kaksois sidosta, ts. Jokaiselle linkille kaksi paria elektronia jakavat.
Metallilinkit
Tämän tyyppinen linkki tapahtuu vain metallielementeissä. Se koostuu saman metallielementin kahden atomin ytimien liitosta yhdessä niiden elektronien kanssa.
Metallilinkeille on ominaista tehokas sähköjohtimet, joilla on erittäin korkea fuusio ja kiehumispiste, ja helposti hapettua. Ne ovat myös muokattavia ja vastustuskykyisiä naarmuille, erittäin vankka ja vahva.
Kuinka metallilinkit ovat?
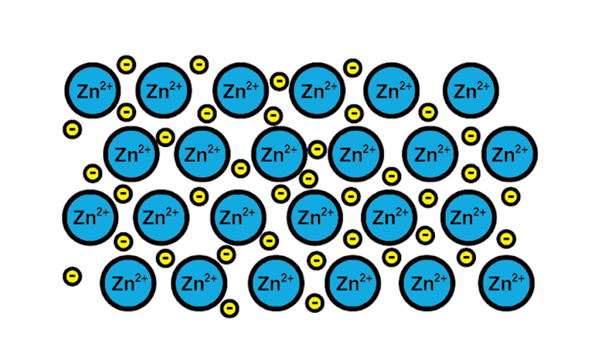 Sinkkimetallinen linkki
Sinkkimetallinen linkki Esimerkki metallisesta linkistä on sinkki, metallinen elementti. Tämän tyyppisen linkin koulutusprosessi on:
Metallielementin 1-A-atomi-ydin täyttää saman elementin toisen ytimen.
2-Molempien ytimien Valencia-kerroksen elektronit tulevat elektronien mereksi. Eli ne eivät kiertäisi yhtä atomi -ydintä.
3-Atomi-ytimien positiiviset kuormat ja elektronien negatiivit houkuttelevat. Tuloksena on valenssielektronit, jotka muodostavat elektronien meren atomien ytimien (kationien) ympärillä.
Se voi palvella sinua: kuparisulfaatti (CUSO4): rakenne, ominaisuudet, hankkiminen, käyttöKemialliset sidosesimerkit
Ionien linkit
- Bariumoksidi (BAO).
- Magnesiumkloridi (MGCL2-A.
- Kalsiumoksidi (CAO)
- Hopea -nitraatti (Agno3-A
- Sinkkihydroksidi (Znoh2-A
- Kaliumbromidi (KBR)
- Kalsiumkarbonaatti (Caco3-A
- Kuparisulfaatti (CuO4-A
- Litiumfluori (LIF)
- Mangaanikloridi (MNCL2-A
- Kaliumsulfaatti (k2Sw4-A
- Rautaoksidi (ruma)
- Dinatriumfosfaatti (NA2HPO4-A
- Kaliumjoduro (KI)
Kovalenttiset linkit
- Hiilidioksidi (CO2-A
- Ammoniakki (NH3-A
- Parafiini (CNH2N+2)
- Diesel (c12H26-A
- Dibromo (BR2-A
- Hiilimonoksidi (CO)
- Butano (c4H10-A
- Bentseeni (c6H6-A
- Molekyylin typpi (n2-A
- Metaani (ch4-A
- Suolahappo (HCL)
- Syanhydrinen happo (HCN)
Metallilinkit
Mikä tahansa sen puhtaan tilan metalli on esimerkki metallisesta linkistä, nimittäin:
- Nikkeli (Ni)
- Rauta (usko)
- Alumiini (AL)
- Titanium (TI)
- Lyijy (PB)
- Koboltti (CO)
- Kupari (Cu)
- Sinkki (Zn)
- Elohopea (HG)
- Kulta (au)
- Hopea (AG)
- Barium (BA)
Kemiallisten sidosten merkitys
Kemiallisten sidosten merkitys on, että ne muodostavat orgaanisia ja epäorgaanisia molekyylejä, ja tällä tavalla ne ovat osa kaikkien elävien organismien pohjaa. Jos niihin kohdistuu tietyissä olosuhteissa, nämä linkit voidaan rikkoa. Tätä energiaa kutsutaan Linkkienergia.
Joitakin linkkien katkaisun tekniikoita sovelletaan sähköllä, korkeilla lämpötiloilla tai kemiallisten reaktioiden provosoimalla eri yhdisteillä.
Esimerkiksi happi- ja vetymolekyylien erottaminen H: sta2Tai voimme levittää sähköä veteen, joka on prosessi, joka tunnetaan nimellä elektrolyysi.
Linkin muodostamat kemialliset yhdisteet ovat lukuisia ja ovat läsnä jokapäiväisessä elämässä. Ruoan maustamiseen käytetty suola on kemiallinen yhdistetuote, joka on natriumin (NA) ja yhden kloorin (CL) atomin (CL) välinen yhteys (CL). Sen kemiallinen kaava on NaCl, joka lukee natriumkloridia.

