Mitkä ovat kemian painolakit? (Esimerkkejä)

- 1681
- 311
- Louis Moen
Se Kemian hoitavat lait He ovat ne, jotka ovat osoittaneet, että reagoivien aineiden massat eivät tee niin mielivaltaisesti tai satunnaisesti; mutta ylläpitää jatkuvaa matemaattista osuutta kokonaislukuista tai niiden alistamista, joissa elementtien atomeja ei ole luotu tai tuhota.
Näiden lakien laatiminen edellytti aikaisemmin poikkeuksellisia päättelypyrkimyksiä; Koska nyt se näyttää liian ilmeiseltä, ennen kuin elementtien tai yhdisteiden atomi- tai molekyylimassat eivät edes tienneet, vastaavasti.
 Lähde: Jeff Keyzer Austinista, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lisenssit/by-SA/2.0)]
Lähde: Jeff Keyzer Austinista, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lisenssit/by-SA/2.0)] Koska ei tiedetty, kuinka tarkalleen kunkin elementin atomien mooli oli ekvivalentti, kahdeksannentoista ja yhdeksännentoista vuosisadan kemikaalien piti perustua reagoiviin massoihin. Niin että alkeelliset analyyttiset asteikot (ylivoimainen kuva) olivat erottamattomia seuralaisia satojen kokeiden aikana, jotka ovat tarpeen painotuslakien ratkaisemiseksi.
Tästä syystä, että kun näitä kemian lakeja tutkitaan, ne kompastuivat massamittauksiin joka hetki. Tämän ansiosta kokeiden tulosten ekstrapoloimalla havaittiin, että kemialliset yhdisteet Puhdas Ne muodostavat aina saman massasopan osittaisista elementeistä.
[TOC]
Massan säilyttämislaki
Tämän lain mukaan kemiallisessa reaktiossa reagenssien kokonaismassa on yhtä suuri kuin tuotteiden kokonaismassa; Niin kauan kuin harkittu järjestelmä on suljettu, eikä sen ympäristön kanssa massaa ja energiaa vaihdeta.
Kemiallisessa reaktiossa aineet eivät katoa, vaan muuttuu muiksi yhtäläisiksi massatuotteiksi; Sieltä kuuluisa lause: "Mitään ei ole luotu, mikään ei tuhota, kaikki muuttuu".
Historiallisesti Mikhail Lomonsov ehdotti kemiallisen reaktion massan säilyttämislaki, joka osoitti päiväkirjassaan kokeidensa tuloksia, jotka osoittivat hänen päiväkirjassaan.
Myöhemmin vuonna 1774 ranskalainen kemisti Antoine Levoisier esitteli kokeidensa tulokset, jotka antoivat tämän selvittää; jota jotkut kutsuvat sitä myös Lavoisierin lakiin.
-Lavoisier -kokeet
Lavoisierin (1743-1794) aikana oli Flogisto, jonka mukaan ruumiilla oli kyky tulehtua tai polttaa. Lavoisier -kokeet saivat hylätä tämän teorian.
Lavoisier suoritti lukuisia metallipalamiskokeita. Hän punnitsi materiaalit varovasti ennen ja jälkeen palamisensa suljetussa astiassa, huomasi, että painonnousu oli ilmeinen.
Mutta Lavoiser, joka perustuu hapen rooliin palamisessa, päätteli, että palamisen painonnousu johtui hapen sisällyttämisestä palamateriaaliin. Metallioksidien käsite syntyi.
Siksi palamisen ja hapen altistuneiden metallien massojen summa pysyi muuttumattomana. Tämä johtopäätös mahdollisti joukkojen suojelulain laatimisen.
-Yhtälöiden tasapainotus
Massansuojelulaki vahvisti tarpeen tasapainottaa kemiallisia yhtälöitä, mikä takaa, että kaikkien kemialliseen reaktioon osallistuvien elementtien lukumäärä, samoin kuin reagenssit tai tuotteet, on täsmälleen sama.
Tämä on olennainen vaatimus tehdyille stökiometrisille laskelmille.
-Laskelmat
Veden moolit
Kuinka monta moolia vettä voi tapahtua viiden moolin metaanin palamisen aikana ylimääräisessä hapessa? Osoittaa myös, että aineen säilyttämisen laki täyttyy.
CH4 + 2 o2 => Co2 + 2 h2JOMPIKUMPI
Tarkkailemalla reaktion tasapainoista yhtälöä, päätellään, että 1 mol metaania tuottaa 2 moolia vettä.
Ongelma voidaan ratkaista suoraan yksinkertaisella lähestymistavalla, koska meillä ei ole 1 mol, mutta 5 moolia CHO: ta4-
Veden moolit = 5 moolia CHO: ta4· (2 moolia H2O / 1 mol CHO: ta4-A
= 10
Mikä vastaa 180 g: ta H: ta2JOMPIKUMPI. Myös muodostettiin 5 mol tai 220 g CO: ta2, joka on yhtä suuri kuin 400 g tuotteita.
Siten alaisen säilyttämisen laki reagoi 400 g reagensseja; ei enempää ei vähempää. Niistä 400 g 80 g vastaa CHO: n 5 moolia4 (kertomalla sen molekyylimassalla 16 g/mol) ja 320 g 10 moolilla O2 (Samoin sen molekyylimassa 32 g/mol).
Magnesiumteipin palaminen
1,50 g: n magnesiumteippi poltettiin suljetussa astiassa, joka sisältää 0,80 g happea. Palamisen jälkeen 0,25 g happea oli säiliössä. a) Mikä happimassa reagoi? b) kuinka paljon magnesiumoksidia muodostettiin?
Voi palvella sinua: Hypotoninen ratkaisu: Komponentit, valmistelu, esimerkkejäReagoitu happimassa saadaan yksinkertaisella erolla.
Hapen massa kulutettu = (alkuperäinen massa - jäännösmassa) happi
= 0,80 g - 0,25 g
= 0,55 g tai2 (to)
Joukkojen suojelulain mukaan,
Magnesiumoksidimassa = magnesiummassa +happimassa
= 1,50 g + 0,55 g
= 2,05 g MGO (b)
Tiettyjen mittasuhteiden laki
Ranskalainen kemisti Joseph Louis Proust (1754-1826), tajusi, että kemiallisessa reaktiossa kemialliset elementit reagoivat aina kiinteissä massa-osuuksissa yhdisteen muodostamiseksi puhdas erityinen; Siksi sen koostumus on vakio lähteestä tai alkuperästä riippumatta tai miten se syntetisoidaan.
Proust vuonna 1799 ilmoitti määriteltyjen mittasuhteiden lain, jossa todetaan: "Kun kaksi tai useampia elementtejä yhdistetään yhdisteen muodostamiseksi, he tekevät niin kiinteässä massasuhteessa". Joten tämä suhde on kiinteä, eikä se ole riippuvainen strategiasta, joka on noudatettu yhdisteen valmistuksessa.
Tätä lakia kutsutaan myös jatkuvan koostumuksen laki, jossa todetaan: "Jokainen puhtauden kemiallinen yhdiste sisältää aina samat elementit, jatkuvassa massaosassa".
-Lain esimerkki
Rauta (usko) reagoi rikin kanssa rautasulfidin (FES) muodostamiseksi, kolme tilannetta voidaan osoittaa (1, 2 ja 3):
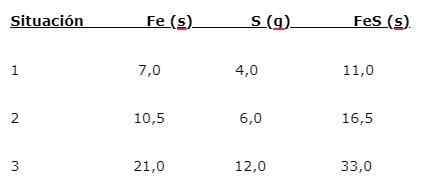
Elementtien yhdistämisen osuuden löytämiseksi tärkein massa (usko) on jaettu pienellä massalla (t). Laskelma antaa osuuden 1,75: 1. Tämä arvo toistetaan annetussa kolmessa olosuhteessa (1, 2 ja 3), missä sama osuus saadaan, vaikka käytetään erilaisia massoja.
Toisin sanoen 1,75 g uskoa yhdistetään 1,0 g: iin S: iin, jotta saadaan 2,75 g FE: tä.
-Sovellukset
Sovelluksen kautta tämä laki, voit tietää tarkalleen niiden elementtien massat, jotka on yhdistettävä yhdisteen halutun massan saamiseksi.
Tällä tavoin voidaan saada tietoja minkä tahansa kemialliseen reaktioon osallistuvien elementtien jäljellä olevasta massasta tai jos reaktiossa on rajoittava reagenssi.
Lisäksi sitä sovelletaan yhdisteen sentimaalisen koostumuksen tuntemiseen, ja viimeksi mainitun perusteella yhdisteen kaava voidaan määrittää.
Yhdisteen sentimaalinen koostumus
Hiilidioksidi (CO2) muodostuu seuraavassa reaktiossa:
C +o2 => Co2
12 g hiiltä 32 g happea yhdistetään 44 g hiilidioksidia.
Joten hiiliprosentti on yhtä suuri kuin
Hiiliprosentti = (12 g / 44 g) · 100 %
= 27,3 %
Happiprosentti = (32 g / 44 g) · 100 %
Happiprosentti = 72,7 %
Käyttämällä vakiokoostumuksen lain lausuntoa voidaan huomata, että hiilidioksidi muodostuu aina 27,3 % hiili ja 72,7 % happea.
-Laskelmat
Rikkitrioksidi
Reagoimalla eri astioissa 4 g ja 6 g rikkiä (S) happea (O), ne saatiin vastaavasti 10 g ja 15 g rikkitrioksidia (niin3-A.
Miksi sellaiset määrät rikkitrioksidia ei?
Laske myös rikin määrä, joka tarvitaan yhdistämään 36 g happea ja saatu rikkitrioksidikina.
Osa A)
Ensimmäisessä astiassa 4 g g happea sekoitetaan 10 g: n trioksidia saamiseksi. Jos sovelletaan massan säilyttämislakia, voimme puhdistaa happimassan, joka yhdistettiin rikkiin.
Happimassa = 10 g happitrioksidia - 4 g rikkiä.
= 6 g
Astiassa 2 6 g rikkiä sekoitetaan x g: n happea 15 rikotrioksidin saamiseksi.
Happimassa = 15 g rikkitrioksidia - 6 g rikkiä
= 9 g
Sitten lasketaan kunkin säiliön osuudet:
Osuus o / s tilanteessa 1 = 6 g o / 4 g s
= 1,5 / 1
Osuus o / s tilanteessa 2 = 9 g o / 6 g s
= 1,5 / 1
Joka on yhtä mieltä siitä, mitä määritettyjen mittasuhteiden laissa nostetaan, mikä osoittaa, että elementit yhdistetään aina samassa suhteessa tiettyyn yhdisteeseen.
Siksi saadut arvot ovat oikeat ja arvot, jotka vastaavat lain soveltamista.
Osa B)
Edellisessä osassa A -arvo 1,5 / 1 laskettiin O / S: n osuudelle.
Voi palvella sinua: aineen yhdistämisen tilatG rikki = 36 happea · (1 g rikkiä / 1,5 g happea)
= 24 g
G rikkitrioksidia = 36 g happea + 24 g rikkiä
= 60 g
Kloori- ja magnesium
Kloori ja magnesium yhdistetään 2,95 g klooria kutakin g magnesiumia kohtaan. a) Määritä kloorin ja magnesiummassat, jotka ovat tarpeen 25 g magnesiumkloridin saamiseksi. b) Mikä on magnesiumkloridin prosentuaalinen koostumus?
Osa A)
CL -suhteen 2,95 -arvon perusteella: mg voidaan tehdä seuraava lähestymistapa:
2,95 g Cl +1 g mg => 3,95 g MGCL: tä2
Sitten:
g Cl = 25 g MGCL: tä2 · (2,95 g cl / 3,95 g mgcl2-A
= 18,67
G mg = 25 g mgclia2 · (1 g mg / 3,95 g mgcl2-A
= 6,33
Sitten 18,67 g klooria yhdistetään 6,33 g magnesiumia 25 g magnesiumkloridin tuottamiseksi.
Osa B)
Magnesiumkloridin molekyylimassa, MGCL lasketaan ensin2-
Mgcl molekyylipaino2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Magnesiumprosentti = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Klooriprosentti = (71 g / 95,3 g) x 100 %
= 74,5 %
Useiden mittasuhteiden laki tai Daltonin laki
Ranskalainen kemisti ja meteorologi John Dalton totesivat lain vuonna 1803 hänen havaintojensa perusteella ilmakehän kaasujen reaktioista.
Laki todettiin seuraavasti: "Kun elementit yhdistetään antamaan useampaa kuin yhtä yhdistettä, yhden heistä muuttuva massa liittyy kiinteään massaan toisesta ja ensimmäisellä on kaanonien ja epäselvien lukujen suhteen".
Lisäksi: "Kun kaksi elementtiä yhdistetään aiheuttamaan erilaisia yhdisteitä, kun otetaan huomioon kiinteä määrä yhtä niistä, toisen elementin eri määrät, jotka yhdistetään kiinteään määrään yhdisteiden tuottamiseksi, ovat suhteessa yksinkertaisiin kokonaislukuihin".
John Dalton teki ensimmäisen modernin kuvauksen atomista kemiallisten elementtien komponentiksi, kun hän huomautti, että elementit muodostuvat jakamattomilla hiukkasilla, joita kutsutaan atomeiksi.
Lisäksi hän postuloi, että yhdisteet muodostuvat, kun eri elementtien atomit yhdistyvät toisiinsa yksinkertaisten kokonaislukujen osissa.
Dalton suoritti Proustin tutkimustyöt. Hän huomautti kahden tinoksidin olemassaolon, jonka prosenttiosuudet olivat 88,1% ja 78,7% tinaa vastaavilla hapen prosenttimäärillä, vastaavasti 11,9% ja 21,3%, vastaavasti 21,3%.
-Laskelmat
Vesi- ja vetyperoksidi
Osoita vesiyhdisteet, H2Tai, ja vetyperoksidi, H2JOMPIKUMPI2, Ne noudattavat useita mittasuhteita.
Elementtien atomipainot: h = 1 g/mol ja happi = 16 g/mol.
Yhdisteiden molekyylipesot: H2O = 18 g/mol ja h2JOMPIKUMPI2 = 34 g/mol.
Vety on elementti, jolla on kiinteä määrä H: ssä2Tai h2JOMPIKUMPI2, Joten O: n ja H: n väliset suhteet luodaan molemmissa yhdisteissä.
O/H -suhde H: ssä2O = (16 g/mol)/(2 g/mol)
= 8/1
O/H -suhde H: ssä2JOMPIKUMPI2 = (32 g/mol)/(2 g/mol)
= 16/1
Molempien mittasuhteiden välinen suhde = (16/1)/(8/1)
= 2
Sitten tai/H: n suhde vetyperoksidin ja veden välillä on 2, kokonaisluku ja yksinkertainen luku. Useiden mittasuhteiden laki on osoitettu.
Typpioksidit
Mikä happimassa yhdistetään 3,0 g typpeä a) typpioksidissa, ei ja b) typpidioksidi, ei2. Osoita, että ei ja ei2 Ne noudattavat useita mittasuhteita.
Typpimassa = 3 g
Atomipainot: typpi, 14 g/mol ja happi, 16 g/mol.
Laskelmat
NO: ssa N: n atomi yhdistetään 1 A -atomiin, niin että happimassa, joka yhdistetään 3 g typpeä, voidaan laskea seuraavalla lähestymistavalla:
G O = g typpi · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g tai
Ei2, N: n atomi yhdistetään 2 O: n atomiin, joten yhdistetty happimassa on:
g happea = 3 g · (32 g/mol/14 g/mol)
= 6,86 g tai
Osuus o/ n kohdalla ei = 3,43 g o/ 3 g n
= 1 143
Osuus tai/n ei2 = 6,86 g o / 3 g n
= 2 282
Suhteen arvo O / N = 2 282 /1 143
= 2
Sitten mittasuhteiden tai/n välisen suhteen arvo on 2, kokonaisluku ja yksinkertainen luku. Siksi useiden mittasuhteiden laki täyttyy.
Vastavuoroisten mittasuhteiden laki
Tämä laki on muotoilla Richter ja Carl F. Wenzel erillinen.
Voi palvella sinua: Natrium: Historia, rakenne, ominaisuudet, riskit ja käyttötarkoituksetEsimerkiksi, jos sinulla on kaksi yhdistettä AB ja CB, havaitaan, että yhteinen elementti on B.
Richter-Wenzelin laki tai vastavuoroiset mittasuhteet sanovat, että tietäen, kuinka suuri osa R: stä B: n kanssa antaa AB: lle ja kuinka paljon C reagoi B: n kanssa CB: n antamiseksi, voit laskea massan, jota tarvitaan reagoida C-massan kanssa toiseen Muoto AC.
Ja tulos on, että suhteessa C: C tai A/C: n on oltava A/B: n tai C/B: n moninkertainen tai alamäki. Tätä lakia ei kuitenkaan aina täytetä, varsinkin kun elementit esiintyvät useita hapettumisvaltioita.
Kaikista painolakeista tämä on ehkä kaikkein "abstrakti" tai monimutkaisin. Mutta jos sitä analysoidaan matemaattisesta näkökulmasta, nähdään, että se koostuu vain muuntamis- ja peruutustekijöistä.
-Esimerkit
Metaani
Jos tiedetään, että 12 g hiiltä reagoi 32 g happea hiilidioksidin muodostamiseksi; ja että toisaalta 2 g vetyä reagoi 16 g happea veden muodostamiseksi, sitten massa -osuudet C/O ja H/tai CO: lle voidaan arvioida2 ja h2Tai vastaavasti.
C/O: n ja H/tai sinulla on:
C / o = 12 g c / 32 g tai
= 3/8
H / O = 2G H / 16G tai
= 1/8
Happi on yleinen elementti, ja halutaan tietää, kuinka paljon hiili reagoi vedyn kanssa metaanin tuottamiseksi; Eli haluat laskea C/H (tai H/C). Sitten on välttämätöntä tehdä aiemmat mittasuhteet osoittaakseen, täyttyykö vastavuoroisuus vai ei:
C/h = (c/o)/(h/o)
Huomaa, että tällä tavalla käyttöjärjestelmä peruutetaan ja C/H pysyy:
C/h = (3/8)/(1/8)
= 3
Ja 3 on 3/8 useita (3/8 x 8). Tämä tarkoittaa, että 3 g C: tä reagoi 1 g: n h: lla metaanin antamiseksi. Mutta pystyä vertaamaan sitä CO: n kanssa2, Se kerrotaan c/h 4: llä, joka on yhtä suuri kuin 12; Tämä antaa 12 g C: tä, joka reagoi 4 g: n H: n kanssa metaanin muodostamiseksi, mikä on myös totta.
Magnesiumsulfidi
Jos tiedetään, että 24 g magnesiumia reagoi 2 g vedyn kanssa magnesiumhydridin muodostamiseksi; Ja lisäksi 32 g rikkiä reagoi 2 g vedyn kanssa rikkivetyjen muodostamiseksi, yhteinen elementti on vety ja haluaa laskea mg/s mg/h ja h/s.
Laske sitten Mg/H ja H/S erikseen:
Mg / h = 24 g mg / 2 g h
= 12
H / S = 2G H / 32G S
= 1/16
S/h on kuitenkin kätevää käyttää H: tä. Siksi s/h on yhtä suuri kuin 16. Tehty tämä, jatkamme MG/S: n laskemista:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
Ja 3/4 on 12 (3/4 x 16) alamittari (3/4 x 16). Mg/S -osuus osoittaa, että 3 g Mg reagoi 4 g rikkiä magnesiumsulfidin muodostamiseksi. Sinun on kuitenkin kerrottava Mg/s 8: lla voidaksesi vertailla sitä Mg/H: llä. Siten 24 g Mg reagoi 32 g rikkiä tämän metallisen sulfidin saamiseksi.
Alumiinikloridi
On tiedossa, että 35,5 g CL reagoi 1 g: n H: n kanssa HCL: n muodostamiseksi. Myös 27 g Al reagoi 3 g: n h: llä ALH: n muodostamiseksi3. Laske alumiinikloridin osuus ja sano, jos tällainen yhdiste tottele Richter-Wenzelin lakia.
Jälleen Cl/H ja AT/H lasketaan erikseen:
Cl / h = 35,5 g cl / 1 g h
= 35,5
At/ h = 27 g at/ 3 g h
= 9
Nyt se on laskettu/cl:
At/cl = (al/h)/(cl/h)
= 9/35,5
≈ 0,250 tai 1/4 (se on oikeastaan 0,253)
Toisin sanoen 0,250 g Al reagoi 1 g: n kanssa CL: n kanssa vastaavan suolan muodostamiseksi. Mutta jälleen kerran, se on kerrottava/cl numerolla, joka mahdollistaa sen vertaamisen (mukavuuden vuoksi) Al/H: n kanssa.
Laskelman epävarmuuskopiot
Sitten se kerrotaan/cl 108: lla (0,27/250), joista se reagoi 108 g: n kanssa Cl: llä. Tätä ei tapahdu tarkasti. Jos otamme esimerkiksi 0,253 -arvon AL/CL: llä ja kerrotaan se 106,7 (27/0,253), 27 g Al reagoi 106,7 g: n kanssa CL; Joka lähestyy enemmän todellisuutta (Alcl3, PA: lla 35,5 g/mol CL: lle).
Täällä havaitaan, kuinka Richterin laki voi alkaa levittää desimaalien tarkkuuden ja väärinkäytön vuoksi.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Kukkia, j. Kemia (2002). Santillana -toimitus.
- Joaquín San Frutos Fernández. (S.F.-A. Paino- ja tilavuuslaki. Palautettu: Encina.pntic.MEC.On
- Toppr. (S.F.-A. Kemiallisen yhdistelmän lait. Toipunut: Toppr.com
- Loistava. (2019). Kemiallisen yhdistelmän lait. Toipunut: loistava.org
- Kemian librettexts. (15. heinäkuuta 2015). Kemialliset lait. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (18. tammikuuta 2019). Massan säilyttämislaki. Toipunut: Admingco.com

