Lämmityskäyrä mikä on, miten se on, esimerkkejä

- 4333
- 552
- Gabriel Fahey
Eräs Lämmityskäyrä Se on graafinen esitys siitä, kuinka näytteen lämpötila vaihtelee ajan funktiona, ylläpitäen vakiopainetta ja lisäämällä lämpöä tasaisesti, eli vakiona nopeudella.
Tällaisen kaavion rakentamiseksi otetaan lämpötila- ja aikearvot, jotka kuvaavat myöhemmin lämpötilan pystysuuntaisella akselilla (järjestetty) ja vaaka -akselin (abscissa) aika (abscissa).
 Kuvio 1. Aineen lämmityskäyrä saadaan lisäämällä lämpöä ja mittaamalla lämpötila joka tietty aikaväli. Lähde: Pixabay.
Kuvio 1. Aineen lämmityskäyrä saadaan lisäämällä lämpöä ja mittaamalla lämpötila joka tietty aikaväli. Lähde: Pixabay. Sitten sopivin käyrä näihin kokeellisiin pisteisiin on säädetty ja lopulta T -lämpötilan kaavio saadaan ajan funktiona t: t (t).
[TOC]
Mikä on lämmityskäyrä?
Lämmittäessä aine käy läpi peräkkäin monimuotoiset valtiot: kiinteä voi höyrystää, melkein aina nestemäisen tilan läpi. Näitä prosesseja kutsutaan valtionmuutoksi.
Lisäämällä lämpöä näytteeseen on kaksi mahdollisuutta:
- Aine nostaa lämpötilaaan ottaen huomioon, että sen hiukkasia sekoitetaan suuremmalla intensiteetillä.
- Materiaali käy läpi vaihemuutoksen, jossa lämpötila pysyy vakiona. Lisää lämpöä heikkenee jossain määrin voimat, jotka pitävät hiukkaset yhtenäisinä, joten esimerkiksi jäästä nestemäiseen veteen on helppo siirtää.
Kuvio 2 esittää neljää aineen tilaa: kiinteä, neste, kaasu ja plasma, ja niiden prosessien nimet, jotka sallivat siirtymisen keskenään. Nuolet osoittavat prosessin merkityksen.
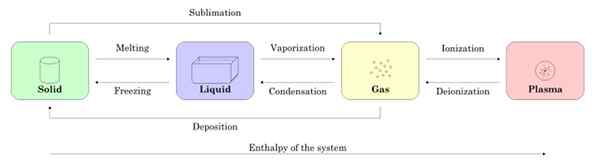 Kuva 2. Kohteen valtiot ja prosessit, jotka ovat tarpeen yhden ja toisen välillä. Lähde: Wikimedia Commons.
Kuva 2. Kohteen valtiot ja prosessit, jotka ovat tarpeen yhden ja toisen välillä. Lähde: Wikimedia Commons. -Valtion muutokset aineella
Alkaen näytteestä kiinteässä tilassa, kun sulaminen kulkee nestemäiseen tilaan, kun se höyrystyy, siitä tulee kaasua ja ionisaation kautta siitä tulee plasma.
Se voi palvella sinua: materiaalien magneettiset ominaisuudetKiinteä voi tulla suoraan kaasua prosessin kautta, joka tunnetaan nimellä sublimaatio. On aineita, jotka ovat helposti sublimeja huoneenlämpötilassa. Tunnetuin on CO2 tai kuiva jää, samoin kuin naftaleeni ja jodi.
Vaikka näyte ylittää tilanmuutoksen, lämpötila pysyy vakiona, kunnes se saavuttaa uuden tilan. Tämä tarkoittaa, että jos esimerkiksi on osa nestemäistä vettä, joka on saavuttanut kiehumispisteensä, sen lämpötila pysyy vakiona, kunnes kaikesta vedestä on tullut höyryä.
Tästä syystä lämmityskäyrän odotetaan koostuvan kasvavien osien ja vaakasuorien osien yhdistelmästä, joissa jälkimmäinen vastaa vaihemuutoksia. Kuvio 3 esittää yhden näistä käyristä tietylle aineelle.
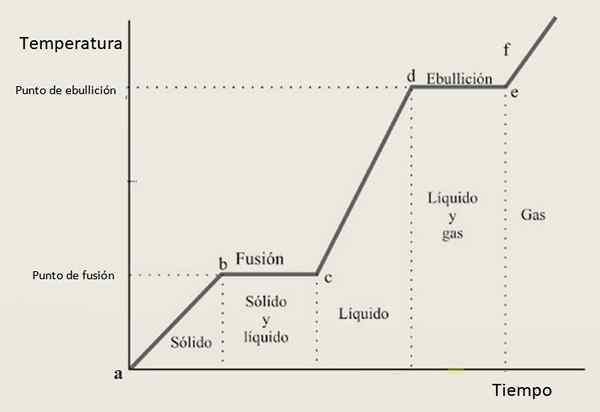 Kuva 3. Tietyn aineen lämmityskäyrä, tyypillisellä kokoonpanolla, joka perustuu vaiheisiin ja rinteisiin.
Kuva 3. Tietyn aineen lämmityskäyrä, tyypillisellä kokoonpanolla, joka perustuu vaiheisiin ja rinteisiin. Lämmityskäyrän tulkinta
Kasvuvälillä Ab, CD ja EF Ainetta löytyy kiinteäksi, nesteeksi ja kaasuksi. Näillä alueilla kineettinen energia kasvaa ja sen myötä lämpötila.
Sillä välin vuonna BC sen tila kiinteästä nesteeseen on muuttumassa, joten kaksi vaihetta esiintyy rinnakkain. Näin on osiossa -, jossa näyte kulkee kaasunesteestä. Tässä on potentiaalienergian muuttaminen, ja lämpötila pysyy vakiona.
Käänteinen menettely on myös mahdollista, toisin sanoen näyte voidaan jäähtyä siten, että se hyväksyy peräkkäin muut valtiot. Tässä tapauksessa puhuu jäähdytyskäyrä.
Lämmityskäyrillä on sama yleinen näkökohta kaikille aineille, vaikka ei tietenkään ole samoja numeerisia arvoja. Jotkut aineet vaativat enemmän aikaa kuin toiset muuttamaan tilaa ja sulaa ja höyrystää eri lämpötiloissa.
Nämä pisteet tunnetaan vastaavasti sulatuspisteinä ja kiehumispisteinä, ja ne ovat kunkin aineen ominaisuuksia.
Voi palvella sinua: tasaiset peilit: yhtälö, käyttäytyminen, grafiikkaSiksi lämmityskäyrät ovat erittäin hyödyllisiä, koska ne osoittavat näiden lämpötilojen numeerisen arvon miljoonille aineille, jotka ovat kiinteitä aineita ja nesteitä lämpötilan alueella, joita pidetään normaalina ja ilmakehän paineessa.
Kuinka lämmityskäyrä tehdään?
Periaatteessa se on hyvin yksinkertainen: se riittää asettamaan aineen näyte säiliöön, joka on varustettu sekoittajan kanssa, lisää lämpömittari ja lämpö tasaisesti.
Samanaikaisesti menettelyn alussa sekuntikello aktivoidaan ja vastaavat lämpötila-parit havaitaan.
Lämmönlähde voi olla kaasun sytytin, jolla on hyvä lämmitysnopeus tai sähkövastus, joka lämpöä emit lämpöä, joka voi yhdistää muuttuvan lähteen saadaksesi erilaisia voimia.
Tarkemman tarkkuuden vuoksi kemian laboratoriossa käytetään kahta tekniikkaa:
- Erilainen lämpöanalyysi.
- Differentiaalinen pyyhkäisykalorimetria.
Ne vertaavat tutkittavan näytteen ja toisen verennäytteen välistä lämpötilaeroa, jolla on korkea sulamislämpötila, melkein aina alumiinioksidi. Näillä menetelmillä pyritään helposti löytämään fuusio- ja kiehumispisteitä.
Esimerkkejä (vesi, rauta ...)
Harkitse kuvan ja raudan lämmityskäyriä, jotka on esitetty kuvassa. Aikataso ei ole esitetty, mutta se on välitön.
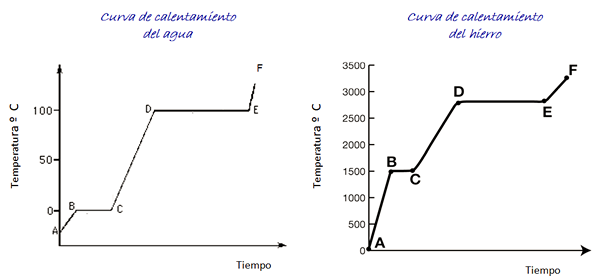 Kuva 4. Vesi- ja raudan lämmityskäyrät.
Kuva 4. Vesi- ja raudan lämmityskäyrät. Vesi on yleinen aine ja lämpötila -alue, joka on tarpeen sen valtionmuutosten näkemiseksi, on helppo saavuttaa laboratoriossa. Raudasta vaaditaan paljon korkeampia lämpötiloja, mutta kuten edellä on osoitettu, kaavion muoto ei muutu huomattavasti.
Voi palvella sinua: Steiner Lause: Selitys, sovellukset, harjoituksetSulamisjää
Kun lämmitetään jäänäyte, kaavion mukaan olemme kohdassa A, alle 0º C: n lämpötilassa. Havaitaan, että lämpötila nousee vakiona nopeudella, kunnes se saavuttaa 0º C.
Jään sisällä olevat vesimolekyylit värähtelevät enemmän leveyttä. Kun sulamislämpötila (piste B) on saavutettu, molekyylit voivat jo liikkua toisen edessä.
Saapuva energia on sijoitettu molekyylien välisen vetovoiman vähentämiseen, joten B: n ja C: n välinen lämpötila pysyy vakiona koko jään suhteen.
Veden kääntäminen höyryksi
Kun vesi on täysin nestemäisessä tilassa, molekyylien värähtely kasvaa uudelleen ja lämpötila nousee nopeasti C: n ja D: n välillä kiehumispisteeseen 100º C. D: n ja E: n välillä lämpötila pysyy siinä arvossa.
Jos kaikki vesihöyry sisältyy säiliöön, sitä voidaan jatkaa pisteestä pisteeseen F, jonka rajaa ei ole esitetty grafiikassa.
Rautanäyte voi ylittää nämä samat muutokset. Materiaalin luonteen vuoksi lämpötila -alueet ovat kuitenkin hyvin erilaisia.
Viitteet
- Atkins, p. Kemian periaatteet: löytöpolut. Pan -american lääketieteellinen toimitus. 219-221.
- Chung, p. Lämmityskäyrät. Palautettu: Chem.Librettexts.org.
- Lämmityskäyrät. Fuusion ja höyrystymisen lämpö. Toipunut: wikipremed.com.
- Hewitt, Paul. 2012. Käsitteellinen fysiikka. Viides. Ed. Pearson. 174-180.
- Valladolidin yliopisto. Kemian tutkinto, palautettu: majoitus.rypäle.On.
- « Carnot Cycle -vaiheet, sovellukset, esimerkit, harjoitukset
- Bromokresolin vihreät ominaisuudet, valmistelu, käyttö »

