Darmstadtio -löytö, rakenne, ominaisuudet, käytöt

- 3116
- 394
- Mr. Clifford Kshlerin
Hän Darmstadtio Se on erittäin raskas kemiallinen elementti, joka sijaitsee transaktiinisarjassa, joka alkaa heti Lawrencio -metallin jälkeen. Se on erityisesti jaksollisen taulukon ryhmässä 10 ja jaksossa 7, jotka ovat nikkeli-, paladium- ja platinametallien yhdistäjät.
Sillä on kemiallinen symboli, jonka atomismäärä on 110, ja sen hyvin harvat syntetisoidut atomit ovat käytännössä hajoavia heti. Siksi se on lyhytaikainen elementti. Syntetisoi ja havaitsee se edusti viime vuosisadan 90 -luvulla, ottaen huomioon löytönsä luottoa saksalaisten tutkijoiden ryhmä.
 Darmstadtio -elementti löydettiin Saksan instituutista GSI: stä, Darmstadtin kaupungista. Lähde: Commander-PIRX Saksan Wikipediassa [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Darmstadtio -elementti löydettiin Saksan instituutista GSI: stä, Darmstadtin kaupungista. Lähde: Commander-PIRX Saksan Wikipediassa [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ennen hänen löytöään ja siitä, että hänen nimensä pitäisi olla, IUPAC-nimikkeistöjärjestelmä oli virallisesti nimetty 'Unaunilio', mikä tarkoittaa 'yhden nolla', yhtä suuri kuin 110. Ja tämän nimikkeistön takana, Mendeleev-järjestelmän mukaan sen nimi oli eka-platino tämän metallin kemiallisesti ajattelemiseksi.
Darmstadtio on elementti, joka ei ole vain lyhytaikainen ja epävakaa, vaan myös erittäin radioaktiivinen, jonka ydin rapistuu suurin osa isotoopeista vapauttaa alfas -hiukkasia; Nämä ovat Helio Naked Ytimiä.
Leikkaavan elämänsä vuoksi kaikki sen ominaisuudet arvioidaan, eikä niitä voida koskaan käyttää tiettyyn tarkoitukseen.
[TOC]
Löytö
Saksalaiset ansiot
Darmstadtio -löydön ongelmana oli, että useat tutkijoiden ryhmät olivat omistautuneet synteesiinsä peräkkäisinä vuosina. Heti kun sen atomi muodostettiin, se haalistui säteilytetyissä hiukkasissa.
Siksi se ei voinut rypistää sitä, mitkä joukkueet ansaitsivat luottoa syntetisoinnista ensin, kun se edes havaitsi sen jo haastetta, laski niin nopeasti ja vapauttavat radioaktiiviset tuotteet.
Se voi palvella sinua: Taniinihappo: rakenne, ominaisuudet, hankkiminen, käyttöDarmstadtio -synteesissä he työskentelivät erillisten ryhmien toimesta seuraavista tutkintakeskuksista: Dubnássa (siihen mennessä Neuvostoliitto), Lawrence Berkeleyn kansallisen laboratorion (Yhdysvallat) ja raskaan ionin tutkimuskeskuksen (lyhennetty saksaksi GSI: ksi (siihen mennessä Neuvostoliitto) keskustutkimusinstituutti (siihen mennessä Neuvostoliitto). -A.
GSI sijaitsee Saksan Darmstadtin kaupungissa, missä marraskuussa 1994 he syntetisoivat radioaktiivisen isotooppin 269Ds. Muut joukkueet syntetisoivat muita isotooppeja: 267Ds iCinissä ja 273DS LNLB: ssä; Sen tulokset eivät kuitenkaan olleet olleet vakuuttavia IUPAC: n kriittisissä silmissä.
Jokainen joukkue oli ehdottanut tiettyä nimeä tälle uudelle elementille: Hahnio (ICIN) ja Bequerelio (LNLB). Mutta IUPAC -raportin jälkeen vuonna 2001 saksalaisella GSI -joukkueella oli oikeus nimittää elementti Darmstadtioksi.
Synteesi
Darmstadtio on tuote metalliatomien fuusiosta. Mikä? Periaatteessa suhteellisen raskas, joka toimii valkoisena tai kohteena, ja toinen valo, joka törmää ensimmäiseen nopeudella, joka on yhtä suuri kuin kymmenesosa valon nopeudesta tyhjiössä; Muutoin sen kahden ytimen välistä torjuntaa ei voitu voittaa.
Kun kaksi ytimtä törmää tehokkaasti, ydinfuusioreaktio tapahtuu. Protonit liittyvät, mutta neutronien kohtalo on erilainen. Esimerkiksi GSI kehitti seuraavan ydinreaktion, jonka ensimmäinen atomi tapahtui 269DS:
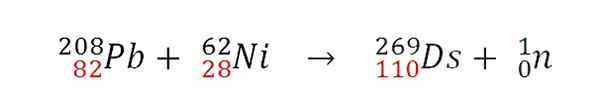 Ydinreaktio isotooppiatomin synteesille. Lähde: Gabriel Bolívar.
Ydinreaktio isotooppiatomin synteesille. Lähde: Gabriel Bolívar. Huomaa, että protonit (punaisella) lisätään. Saavutaan törmättyjen atomien atomien massat, saadaan erilaiset darmstadtio -isotoopit. Itse asiassa GSI kokeili isotooppia 64Eikä sen sijaan 62Eikä niistä, jotka syntetisoivat vain 9 isotoopin atomia 271Ds.
Voi palvella sinua: AldehydosGSI onnistui luomaan 3 atomia 269DS, mutta suoritettuaan kolme biljoonaa pommitusta sekunnissa koko viikon ajan. Nämä tiedot tarjoavat ylivoimaisen näkökulman tällaisten kokeiden ulottuvuuksista.
Darmstadtio -rakenne
Koska vain Darmstadtio -atomi viikossa voidaan syntetisoida tai luoda, ei todennäköisesti ole tarpeeksi kristallin perustamista; Puhumattakaan siitä, että vakain isotooppi on 281Ds, jonka t1/2 Se on vain 12,7 sekuntia.
Siksi niiden kiteisen rakenteen määrittämiseksi tutkijat perustuvat laskelmiin ja arvioihin, joilla pyritään lähestymään todellista panoraamaa. Siten on arvioitu, että Darmstadtio -rakenne on kuutiometriä keskittynyt vartaloon (BCC); Toisin kuin niiden kevyimmän nikkeli-, paladium- ja platina -yhdisteiden, kuutiometrien rakenteet keskittyvät kasvoihin (FCC).
Teoriassa Orbitaalien 6D- ja 7S: n uloimpien elektronien on osallistuttava heidän metallisiin linkkiinsä arvioidun elektronisen kokoonpanon mukaan:
[RN] 5F146D87s2
Se kuitenkin todennäköisesti tunnetaan kokeellisesti tämän metallin fysikaalisista ominaisuuksista.
Ominaisuudet

Myös Darmstadtio -ominaisuuksien muut ominaisuudet arvioidaan samoista syistä, jotka on mainittu sen rakenteeseen. Jotkut näistä arvioista ovat kuitenkin mielenkiintoisia. Esimerkiksi Darmstadtio olisi vieläkin jalo metalli kuin kulta, samoin kuin erittäin tiheä (34,8 g/cm3) Osmium (22,59 g/cm3) ja El Mercurio (13,6 g/cm3-A.
Mahdollisten hapetustilojen suhteen on arvioitu, että se olisi +6 (DS6+), +4 (DS4+) ja +2 (DS2+), yhtä suuri kuin heidän kevyempien ikäisensä. Siksi, jos atomit 281DS ennen kuin ne hajoavat, saadaan yhdisteet, kuten DSF6 tai DSCL4.
Se voi palvella sinua: 50 esimerkkiä hapoista ja emäksistäYllättäen on todennäköistä syntetisoida näitä yhdisteitä, koska 12,7 sekuntia, t1/2 niistä 281DS, se on enemmän kuin tarpeeksi aikaa reaktioiden tekemiseen. Häiriöt ovat kuitenkin edelleen, että vain DS: n atomi viikossa ei ole riittävä kerätä kaikki tilastollisen analyysin edellyttämät tiedot.
Sovellukset
Jälleen, koska se on niin niukasti metalli, joka on tällä hetkellä syntetisoitu atomilla eikä massiivisilla määrillä, hänelle ei ole varattu mitään; Edes kaukaisessa tulevaisuudessa.
Ellei menetelmää radioaktiivisten isotooppien vakauttamiseksi, Darmstadtio -atomeja käytetään vain tieteellisen uteliaisuuden herättämiseen, etenkin ydinfysiikan ja kemian suhteen.
Mutta jos mitään tapaa luoda niitä runsaasti määriä hallitaan, tämän erittäin raskaan ja lyhytaikaisen elementin kemiaan heitetään enemmän valoja.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Darmstadium. Haettu: vuonna.Wikipedia.org
- Steve Gagnon. (S.F.-A. Elementti Darmstadium. Jefferson Lab -resurssi. Toipunut: Koulutus.JLAB.org
- Kansallinen bioteknologiatietojen keskus. (2020). Darmstadium. Pubchem -tietokanta. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Brian Clegg. (15. joulukuuta 2019). Darmstadium. Kemia sen elementteissä. Toipunut: ChemistryWorld.com
- « Hapettumisnumerokonsepti, miten se pääsee ulos ja esimerkkejä
- Molaarinen massa miten se lasketaan, esimerkit ja harjoitukset ratkaistu »

