Dibenzalacetonan ominaisuudet, reaktiomekanismi, käyttö, riskit

- 1493
- 224
- Edgar VonRueden
Se Dibenzalacetona (DBA) on orgaaninen yhdiste, jonka molekyyl kaava on c17H14JOMPIKUMPI. Se on kellertävä aine, joka sen puhtaudesta riippuen voidaan esitellä kiteinä. Sitä käytetään aurinkovoiteissa ja organimetaalisessa synteesissä, jossa paladiumia käytetään katalyyttinä.
Vaikka sen synteesi on suhteellisen yksinkertainen, melko toistuva prosessi laboratorioiden opetuslaboratorioissa selittämään aldoolista kondensaatiota, sen mekanismi on hiukan laaja, useita tekijöitä tulisi ottaa huomioon. Käytetty bentsaldehydi, joka tiivistyy asetonin kanssa, on tislataan vasta sen takaamiseksi sen alhaisen hapettumisen kanssa kosketuksessa ilman kanssa.
 Dibenzalacetonan näyte lasisäiliössä. Lähde: Stephanb [CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]
Dibenzalacetonan näyte lasisäiliössä. Lähde: Stephanb [CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Samoin etanoli-vesi-väliainetta käytetään reagenssien liuottamiseen ja samalla edistämään dibentsalasetonin, hydrofobisen ja liukenemattoman yhdisteen lopullista saostumista. Toistaiseksi ei tiedetä, mitkä negatiiviset vaikutukset voivat käyttää dibentsalacetonia organismiin tai ympäristöön sen sijaan, että ne olisivat ärsyttäviä aineita.
[TOC]
Ominaisuudet
Fyysinen ulkonäkö
Kiinteä kellertävä pölyinen tai kiteinen ulkonäkö.
Moolimassa
234,29 g/mol
Isomeerit
Dibentsalasetoni esitetään kolmeksi geometriseksi isomeeriksi: trans-trans-trans-cis ja cis-cis. Trans-trans-isomeeri on kaikki vakain ja siksi se, joka esiintyy eniten synteesin aikana.
Sulamispiste
110-111 ºC. Tämä alue vaihtelee syntetisoidun kiinteän aineen puhtauden asteen mukaan.
Vesiliukoisuus
Liukenematon.
Rakenne
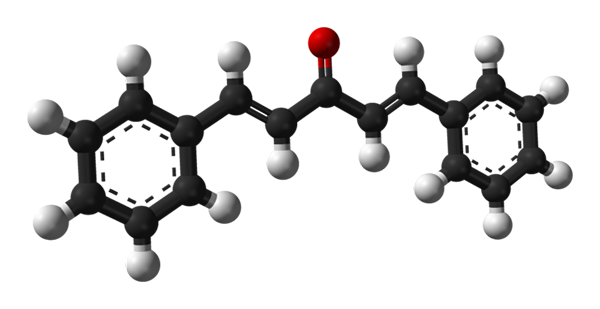 Dibentsalasetonin molekyylirakenne. Lähde: Benjah-BMM27 [julkinen alue]
Dibentsalasetonin molekyylirakenne. Lähde: Benjah-BMM27 [julkinen alue] Yläkuvassa on esitetty trans-trans-trans-isomeerin molekyyli. Sen keskellä meillä on karbonyyliryhmä ja sen sivuilla, kaksoissidokset ja kaksi aromaattista bonenceno -rengasta.
Dibentsalasetoni on apolaarisessa ja hydrofobisessa olemuksessa, koska sen koko rakenne koostuu käytännössä hiili- ja vetyatomeista. Karbonyyliryhmä antaa sille vain pienen dipolin hetken.
Voi palvella sinua: Alumiinifosfuro (AIP): rakenne, ominaisuudet, käytöt, riskitRakenne voidaan rinnastaa arkin rakenteeseen, koska kaikilla sen hiiliatomilla on SP -hybridisaatio2; Siksi ne lepäävät samassa tasossa.
Kevyet fotonit ovat vuorovaikutuksessa dibentsalacetonan konjugoidun π -järjestelmän kanssa; etenkin UV -säteilyn säteily, imeytyminen herättämään siirrettyjä elektroneja. Tämä ominaisuus tekee dibentsalacetonasta erinomaisen absorboivan ultraviolettivalon.
Dibentsalacetonan reaktiomekanismi
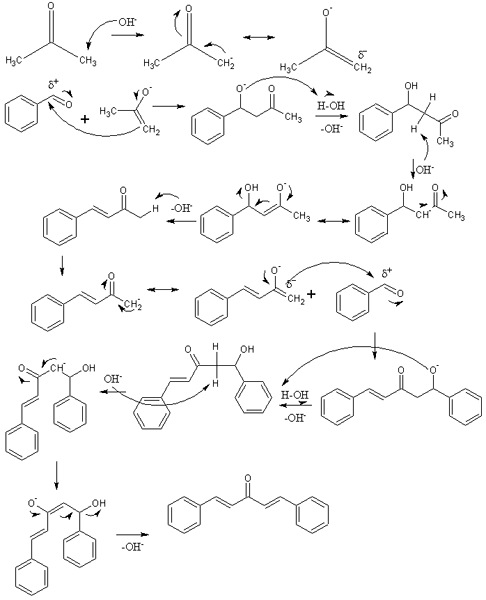 Aldoolisen kondensaation mekanismi dibentsalacetonan synteesissä. Lähde: Izmaelt [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Aldoolisen kondensaation mekanismi dibentsalacetonan synteesissä. Lähde: Izmaelt [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ylemmässä kuvassa olemme edustaneet aldoolisen kondensaation mekanismia bentsaldehydin ja asetonin välillä dibentsalasetonin perustamiseksi; Erityisesti sen trans-trans-isomeeri.
Reaktio alkaa asetonilla emäksisessä väliaineessa. VAI NIIN- Kummankin metyyliryhmän happoprotoni,3, Sisaran aiheuttaminen: Cho3C (o) ch2-, joka muuttaa sen negatiivisen resonanssikuorman (kuvan ensimmäinen rivi).
Tämä inolaatti toimii sitten nukleofiilisenä aineena: hyökkää bentsaldehydin molekyylin karbonyyliryhmään. Sen sisällyttäminen bentsaldehydiin tuottaa alkoholin, joka on hyvin emäksinen tuhoisa vesimolekyyli ja siitä tulee aldoli (toinen rivi). Aldoli- tai β-hydroksikithonille on ominaista, että sillä on ryhmät c = o ja OH.
Perusväliaineen dehydraatit Tämä aldoli ja kaksinkertainen sidos muodostuvat sen rakenteeseen, joka tuottaa bentsyylideeneacetonia (kolmas rivi). Sitten, oi- Myös epämääräinen yksi sen happamista hydrogeista, toistaen toisen nukleofiilisen hyökkäyksen toiseen bentsaldehydimolekyyliin. Tällä kertaa hyökkäys tapahtuu yhtä nopeasti (neljäs rivi).
Tuote muodosti suojaamattoman toisen vesimolekyylin ja kärsii jälleen kuivumisesta OH -ryhmän poistamiseksi ja toisen kaksoissidoksen luomiseksi (viides ja kuudes rivi). Siten ja lopuksi dibentsalacetona tapahtuu.
Voi palvella sinua: Boyle LawSynteesi
Reagenssit
Reagenssit dibentsalasetonin synteesin suorittamiseksi ovat seuraavat:
- 95% etanoli.
- Äskettäin tislattu bentsaldehydi katkerasta manteliöljystä.
- NaOH tislatun veden emäksisen katalysaattorina.
Käytettävät määrät riippuvat siitä, kuinka paljon dibentsalasetonia sen tarkoituksena on syntetisoida. Bentsaldehydiä on kuitenkin ylimääräinen, koska osa siitä hapettuu bentsoehapoksi. On myös taata, että reaktio vie vähemmän aikaa ja että ei -toivottu bentsyylideeneacetoni tuotetaan vähemmässä määrin.
Etanoli toimii bentsaldehydin liuottimena, koska muuten se ei liukene NaOH: n perusympäristöön.
Menettely
Suuressa saoslasissa etanoli sekoitetaan bentsaldehydin kanssa. Sitten NaOH: n perusväliaine lisätään vakiona magneettisen levottomuuden aikana. Tässä vaiheessa Cannizzaro -reaktio tapahtuu; Toisin sanoen kaksi bentsaldehydimolekyyliä ovat suhteettomia yhdessä bentsyylialkoholista ja toisesta bentsoehaposta, helposti tunnistettavissa sen tyypillisellä makealla hajulla.
Lopuksi lisätään asetonia ja puoli tuntia odotetaan, että ratkaisu tulee pilvistä ja kelta-oranssia väriä. Dibentsalacetona saostuu veden takia, joten sen täydellisen sademäärän edistämiseksi lisätään huomattavaa määrää vettä.
Dibenzalacetona suodattimet tyhjiöön ja sen kellertävä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä kiinteä.
Uudelleenkiteytys
 Uudelleenkiteytetyn dibentsalacetonan näyte on käytettävä samanlainen kiilto kuin tämän kuvan kiteillä. Lähde: Smokefoot [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Uudelleenkiteytetyn dibentsalacetonan näyte on käytettävä samanlainen kiilto kuin tämän kuvan kiteillä. Lähde: Smokefoot [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Dibentsalasetonin, 95 -prosenttisen etanolin tai kuuman etyyliasetaatin puhdistamiseksi käytetään niin, että jokaisen kerran uudelleenkiteyttämisen jälkeen saadaan enemmän puhtauskiteitä. Siten alkuperäinen kellertävä pöly transformoituu pieniksi keltaisiksi dibentsalacetonan keltaisiksi kiteiksi.
Voi palvella sinua: bentsoehappo (C6H5COOH)Sovellukset
Dibentsalacetona on yhdiste, jolla ei ole liian monia käyttötarkoituksia. Koska sitä kykenee absorboida ultraviolettivaloa, sitä käytetään aurinkovoideiden formulaatiossa tai muussa tuotteessa, joka vaivaa UV -säteiden, joko pinnoitteiden tai maalausten esiintyvyyttä.
Toisaalta dibentsalasetonia käytetään paladiumin organometallisessa synteesissä. Se toimii sitovana, joka koordinoi metallisia paladium -atomeja, PD0 -, Tris -kompleksin (dibenzeneacetona) dipaladio (0) muodostamiseksi (0).
Tämä organometalli yhdiste tarjoaa PD -atomeja0 - Erilaisessa orgaanisessa synteesissä, joten se käyttäytyy homogeenisena katalyyttinä, koska se liukenee moniin orgaanisiin liuottimiin.
Samoin dibentsalacetona sideaineena on helppo korvata muilla orgaanisilla sideaineilla, mikä antaa paladiumin organometalliselle synteesille kehittyä.
Riskejä
Riskien suhteen ei ole paljon saatavilla olevaa tietoa, joka raportoi mahdollisista vaikutuksista terveyteen tai ympäristöön, joka voi johtaa dibentsalacetoniin. Puhtaassa tilassaan se on ärsyttävä kiinteä nielemistä, hengitystä tai suoraa kosketusta silmiin tai ihoon.
Se ei kuitenkaan ole ilmeisesti tarpeeksi ärsyttävää, jotta se ei voi olla osa aurinkovoideiden formulaatioita. Toisaalta, koska se on niin liukenematon veteen, sen pitoisuus siihen on vähäinen, esittäen itsensä kiinteäksi epäpuhtaukseksi. Tässä mielessä ei tiedetä, kuinka haitallista se on meren eläimistölle tai maaperää aiheuttavaa sameutta, joka.
Kunnes päinvastoin on osoitettu.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Dibentsyylideneaceton. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Dibentsyylideneaceton. Pubchem -tietokanta., CID = 640180. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Orgaaniset synteesit. (2020). Dibentsalaketoni. Haettu: Orsyn.org
- Dibentsalasetoni aldolin kondensaatiolla. Haettu: Web.Mnstate.Edu
- « Lämmön pilaantumisen ominaisuudet, seuraukset, esimerkit
- Jodometrian perusteet, reaktiot, yleinen menettely, käyttö »

