Dimetyyliamiini ((CH3) 2NH) rakenne, ominaisuudet, käyttö, riskit
- 4403
- 211
- Sheldon Kuhn
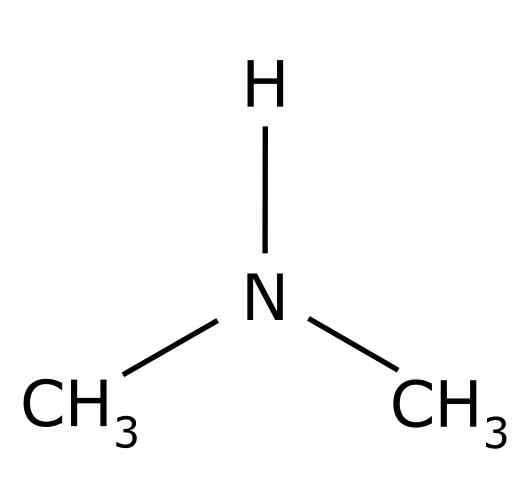
Se dimetyyliamiini Se on orgaaninen yhdiste, jonka muodostaa kaksi metyyliryhmää -CH3 Yhdistynyt -nh -ryhmään. Sen kemiallinen kaava on (CHO3-A2Nh. Se on väritön kaasu. Kun kalan haju havaitaan ilmassa alhaisina pitoisuuksilla. Jos se on kuitenkin korkeassa pitoisuudessa, sillä on ammoniakin nh haju3.
Dimetyyliamiinia on läsnä kasveissa ja eläimissä. Uskotaan, että ihmisessä tulee tiettyjen entsyymien hajoamisesta, mutta myös joidenkin elintarvikkeiden, kuten kalan, nauttimisesta. Jos dimetyyliamiinikaasu liukenee veteen, se muodostaa erittäin emäksisen ja syövyttävät liuokset.
 Dimetyyliamiini. Ring0 [julkinen alue]. Lähde: Wikimedia Commons.
Dimetyyliamiini. Ring0 [julkinen alue]. Lähde: Wikimedia Commons. Sillä on erilaisia teollisuuskäyttöä, kuten liuottimien tuottamiseen, kumin vulkanoinnin nopeuttamiseksi.
Dimetilamiini on erittäin syttyvä kaasu. Sitä sisältäviä astioita ei pitäisi altistaa lämmölle tai tulipalolle, koska ne voivat hyödyntää. Lisäksi heidän höyrynsä ovat ärsyttäviä silmiä, ihoa ja hengitysteitä.
Se on yhdiste, joka voi olla osa ilmakehän ilmakehästä löytyviä ilmakehän aerosoleja, ts.
[TOC]
Rakenne
Dimetilamiini on toissijainen alifaattinen amiinia. Tämä tarkoittaa, että typpisubstituentit (n) ovat alifaattisia (-CH3), mikä tarkoittaa, että he eivät ole aromaattisia ja että he ovat kaksi. Siksi metyyli -CH on kaksi3 Yhdistynyt typpi, jolla on myös vety (H).
Dimetyyliamiinimolekyylissä typessä (N) on pari vapaita elektroneja, toisin sanoen pari elektronia, jotka eivät ole yhdistyneitä muuhun atomiin.
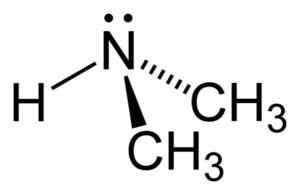 Dimetyyliamiinin rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Dimetyyliamiinin rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nimikkeistö
- Dimetyyliamiini
- N, N-dimetyyliamiini
- N-metyylimetanamiini
- DMA (lyhenne di-metyyli-amiini).
Ominaisuudet
Fyysinen tila
Väritön kaasu.
Molekyylipaino
45,08 g/mol
Sulamispiste
-93 ºC
Kiehumispiste
7,3 ºC
Leimahduspiste
-6,69 ºC (suljettu kuppimenetelmä).
Itsensuuntainen lämpötila
400 ° C
Voi palvella sinua: Useiden mittasuhteiden lakiTiheys
Neste = 0,6804 g/cm3 A 0 ºC.
Höyry = 1,6 (suhteellinen tiheys ilman suhteen, ilma = 1).
Liukoisuus
Hyvin liukoinen veteen: 163 g/100 g vettä 40 ° C: ssa. Liukoinen etanoli- ja etyylieetteriin.
PHE
Vesipitoiset dimetyyliamiiniliuokset ovat voimakkaasti emäksisiä.
Dissosiaatiovakio
K -k -b - = 5,4 x 10-4
Pk-lla konjugoitua happoa = 10 732 - 25 ° C. Konjugaattihappo on dimetyyliamoniumioni: (CHO3) NH2+
Kemialliset ominaisuudet
Nestemäinen dimetyyliamiini voi hyökätä joitain muoveja, renkaita ja pinnoitteita.
Kun liukenee veteen, typen vapaa elektronipari (n) ottaa protonin (H+) vettä, jättäen vapaa-, Joten se muodostaa erittäin emäksisen ja syövyttävät ratkaisut:
Dimetyyliamiini + vesi → Dimetyyliamonium -ioni + hydroksyyli -ioni
(CH3-A2NH + H2O → (Valitse3-A2Nh2+ + vai niin-
Typpihapolla saadaan nitraattisuola, toisin sanoen dimetyylän amotylamoniumnitraatti:
Dimetyyliamiini + typpihappo → Dimetyyliamoniumnitraatti
(CH3-A2NH +HNO3 → (ch3-A2Nh2+EI3-
Muut ominaisuudet
Kun alhaisessa ilmapitoisuudessa on kala samanlainen haju, kun taas korkeissa pitoisuuksissa se haisee ammoniakkia (NH3-A.
Biokemialliset reaktiot
Organismissa dimetyyliamiini voi kärsiä nitrillaarista heikosti happamissa olosuhteissa, jotta dimetyylnitrosamiini on syöpää aiheuttava yhdiste (CH CH3-A2N-ei.
Dimetlnitrosamiinin muodostuminen tapahtuu vatsassa (pH 5-6) dimetyyliamiinista ja nitriitistä (natriumnitriitti) vaikutuksesta maha-suolikanavassa olevien bakteerien vaikutuksesta. Joissakin elintarvikkeissa on natriumnitriittiä.
Dimetyyliamiini + natriumnitriitti → dimetyylnitrosamiini + natriumhydroksidi
(CH3-A2NH + Nano2 → (ch3-A2N-ei + NaOH
Saada
Dimetilamiini valmistetaan kaupallisesti reagoimalla metanolia (valitse3Voi) ammoniakkiin (NH3) lämpötilassa 350-450 ° C piidioksidi-aluminina-katalyyttiä (SIO2/2JOMPIKUMPI3-A.
2 ch3Voi + NH3 → (ch3-A2NH + 2 H2JOMPIKUMPI
Koska monometyyliamiinia ja trimetyyliamiinia on myös tuotettu.
Läsnäolo luonnossa
Dimetyyliamiinia löytyy kasveista ja eläimistä. Se on läsnä myös luonnollisesti ja runsaasti ihmisen virtsassa.
Se voi palvella sinua: Epoksidi: nimikkeistö, hankkiminen, sovellukset, esimerkitOn arvioitu, että sen läsnäolo ihmisillä johtuu siitä, että tietyntyyppiset suolen bakteerit tuotetaan joistakin ruoasta löydetyistä yhdisteistä.
Jotkut näistä yhdisteistä ovat mäkeä (yhdiste, joka liittyy vitamiiniryhmään B) ja trimetyyliamiinioksidiin. Uskotaan myös, että se tulee kehossa muodostuneen typpioksidin (NO) entsyymi -estäjästä.
Tietyt tietolähteet osoittavat, että dimetyyliamiinin lisääntyminen virtsassa johtuu meren kalojen ja hedelmien nauttimisesta, missä pääarvot saadaan, kun ne syövät kalmaria, aavea, sardiineja, miekkakala-, turskaa, kaloja ja linjaa.
 Kalojen syöminen voi lisätä dimetyyliamiinitasoja virtsassa. Kirjoittaja: Anna Sulencha. Lähde: Pixabay.
Kalojen syöminen voi lisätä dimetyyliamiinitasoja virtsassa. Kirjoittaja: Anna Sulencha. Lähde: Pixabay. Potilaat, joilla on ylimääräinen dimetyyliamiini
Katsottaan, että dimetyyliamiini on ureeminen toksiinia, ts. Aine, joka voi aiheuttaa vaurioita, jos sen pitoisuus virtsaan nostetaan. Itse asiassa munuaissairauspotilailla on havaittu erittäin korkeita dimetyyliamiinitasoja terminaalivaiheessa.
Uskotaan, että näillä potilailla voi olla suolistobakteereja, jotka voisivat tuottaa sitä.
Sovellukset
DMA: ta tai DMA: ta käytetään:
- Muiden yhdisteiden valmistus.
- Dimetyylimuotoamidin ja dimetyyliasetamidiliuottimien tuotanto.
- Nopeuttaa tiettyjen ikenien vulkanisointia.
- Poista hiukset parkituksen aikana.
- Toimia liuottimien antioksidanttina.
- Toimi mineraalien vaahdotusaineena.
- Estää korroosiota ja anti -Sniff -aineena.
- Toiminta pinta -aktiivisena aineena.
- Tehdä saippuat ja pesuaineet.
- Toimia kemistinä tekstiileinä.
- Toiminta polttoaineena antifuettina ja kaasunvakauslaitteena.
- Valmistaa väriaineita.
- Absorboida happosaasuja.
- Toimi torjunta -aineet ja raketit.
- Olla osa vedenkäsittelyä koskevia aineita.
- Toimia fungisidinä maatalouskemiallisissa tuotteissa.
- Jo lopetettu käyttö, kuten puuvillaa hyökkäävät gorgjos- tai hyönteisten houkutteleminen ja tuhoaminen.
 Puuvillakasvi. Kirjoittaja: Isaa KC. Lähde: Pixabay.
Puuvillakasvi. Kirjoittaja: Isaa KC. Lähde: Pixabay.  Aikaisemmin puuvillakasveja hyönteisiä hyönteisiä eliminoitiin dimetyyliamiinilla. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Aikaisemmin puuvillakasveja hyönteisiä hyönteisiä eliminoitiin dimetyyliamiinilla. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Riskejä
Dimetilamiinihöyryt ovat ärsyttäviä ihoa, silmiä ja hengitystiloja.
Voi palvella sinua: epäorgaaniset yhdisteetJos joudut kosketukseen ihon kanssa nestemäisessä muodossa, voi aiheuttaa jäätymistä ja kemiallista palamista. Sen hengittämisellä on haitallisia terveysvaikutuksia.
DMA -kaasu on syövyttävä ja voi muodostaa syövyttäviä vesiliuoksia. Vesipitoiset liuokset voivat tulla syttyviksi, elleivät ne ole melko laimennettuja.
Kaasun muotoinen dimetyyliamiini on helposti tulehtunut tuottamalla typpioksidien myrkyllisiä höyryjä (eix-A.
Jos tätä kaasua sisältävä säiliö altistetaan voimakkaalle lämmölle tai lämmölle, se voi räjähtää.
DMA: n vaikutus ilmakehään
Ilmakehän aerosolilla (erittäin pienet pisarat luonnollisista yhdisteistä ja/tai ilmakehän epäpuhtauksista) on syvä vaikutus maailmanlaajuiseen ilmastoon ja ilmanlaatuun maailman eri alueilla.
Uusien aerosolihiukkasten muodostumista ei vielä ymmärretä täysin.
Arvioidaan, että dimetyyliamiini osallistuu yhdessä muiden yhdisteiden kanssa näiden hiukkasten muodostumisessa, mikä näyttää riippuvan vahvojen DMA -päästöjen alueesta.
Esimerkiksi teollisuusalueilla on suurempi keskittyminen kuin maatalousalueilla, ja tämä voi vaikuttaa DMA: n osallistumiseen.
On huomattava, että joidenkin tutkijoiden mukaan glyfosaattia sisältävän kasvimateriaalin polttaminen (yksi maailman eniten käytettyistä rikkakasvien torjunta -aineista) voi johtaa dimetyyliamiinin muodostumiseen.
 Ilmakehän aerosolit Etelä -Amerikassa. Dimetilamiini voisi vaikuttaa sen muodostumiseen. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Ilmakehän aerosolit Etelä -Amerikassa. Dimetilamiini voisi vaikuttaa sen muodostumiseen. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Dimetyyliamiini. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Morrison, r.T. ja Boyd, R.N. (2002). Orgaaninen kemia. 6. painos. Prentice-sali.
- Windholz, m. et al. (Toimittajat) (1983). Merck -indeksi. Kemikaalien, lääkkeiden ja biologisten enyclopedia. Kymmenes painos. Merck & Co., Inc.
- Abramowitz, m.K -k -. et al. (2010). Uremian patofysiologia. Alifaattiset amiinit. Kroonisessa munuaissairaudessa, dialyysissä ja siirrossa (kolmas painos). ScienEdirect.com.
- Li, h. et al. (2019). Ilmakehän olosuhteiden vaikutus rikkihappo-dimetyyliamiini-ammoniapohjaiseen uuteen hiukkasten muodostumiseen. Chospher 2019; 245: 125554. NCBI toipunut.Nlm.NIH.Hallitus.
- Mackie, J.C. ja Kennedy, ja.M. (2019). Glyfosaatin ja kappaleiden pyrolyysi myrkylliset tuotteet. Ympäristö. Sci. Tekniikka. 2019: 53 (23): 13742-13747. NCBI toipunut.Nlm.NIH.Hallitus.
- « Jorge Edwardsin elämäkerta, tyyli ja teokset
- Pallomaiset koordinaatit esimerkit ja harjoitukset ratkaistu »

