Hiilidisulfidi (CS2) rakenne, ominaisuudet, käytöt, riskit
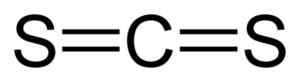
- 2302
- 486
- Joshua Emmerich
Hän hiilidisulfidi Se on yhdiste, joka on muodostettu hiiliatomin (C) ja kahden rikkitomien yhdistämisessä. Sen kemiallinen kaava on CS2. Se on väritön tai hiukan keltainen neste, jolla on epämiellyttävä haju sen sisältämien epäpuhtauksien vuoksi (rikkiyhdisteet). Kun puhdasta haju on pehmeä ja makea, samanlainen kuin kloroformi tai eetteri.
Se on luonnollisesti peräisin auringonvalon vaikutuksesta orgaanisiin molekyyleihin, joita löytyy merivedestä. Lisäksi sitä esiintyy suiden vesillä ja se on karkotettu myös tulivuorista yhdessä muiden kaasujen kanssa.
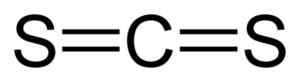 CS -hiilidisulfidi2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
CS -hiilidisulfidi2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Hiilidisulfidi on haihtuva neste ja on myös erittäin syttyvä, joten se on pidettävä poissa liekkeistä ja kipinöistä tai laitteista, jotka voivat tuottaa niitä, mukaan lukien sähköpultit.
Sillä on kyky liuottaa suuri joukko yhdisteitä, materiaaleja ja elementtejä, kuten fosforia, rikkiä, seleeniä, hartsia, lakkaa jne. Siksi se löytää hyödyllisyyden liuottimena.
Se on myös välittäjä erilaisissa teollisissa kemiallisissa reaktioissa, kuten Rayonin tuotanto tai keinotekoinen silkki.
Sitä on manipuloitava varoen ja suojausvälineillä, koska se on erittäin myrkyllinen ja vaarallinen.
[TOC]
Rakenne
Hiilidisulfidissa on hiiliatomi ja kaksi rikkitomia tämän sivulla.
Hiiliatomin ja rikkiatomien väliset yhteydet ovat kovalenttisia ja kaksinkertaisia, siksi ne ovat erittäin vahvoja. CS -molekyyli2 Sillä on lineaarinen ja symmetrinen rakenne.
 Hiilidisulfidin lineaarinen rakenne CS2. Musta = hiili, keltainen = rikki. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Hiilidisulfidin lineaarinen rakenne CS2. Musta = hiili, keltainen = rikki. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nimikkeistö
- Hiilidisulfidi
- Hiilibisulfidi
- Ditiokarbonic anhydridi
Ominaisuudet
Fyysinen tila
Väritön tai kellertävä.
Molekyylipaino
76,15 g/mol
Fuusio- tai jähmettymispiste
-110,8 ° C
Kiehumispiste
46,0 ºC
Leimahduspiste
-30 ºC (suljettu kuppimenetelmä).
Itsensuuntainen lämpötila
90 ° C
Tiheys
Neste = 1,26 g/cm3 20 ºC.
Höyry = 2,67 kertaa ilma.
Sen höyryt ovat yli kaksinkertaisia raskaita kuin ilma ja neste on raskaampi kuin vesi.
Höyrynpaine
279 mmHg 25 ° C: ssa.
Voi palvella sinua: kaliumhypokloriitti (KCLO)Tämä on korkea höyrynpaine.
Liukoisuus
Hyvin pieni vesiliukoinen: 2,16 g/l a 25 ° C. Liukoinen kloroformiin. Sekoittuu etanolin, metanolin, eetterin, bentseenin, kloroformin ja hiilitetrakloridin kanssa.
Kemialliset ominaisuudet
CS2 Se haihtuu helposti huoneenlämpötilassa, koska sen kiehumispiste on erittäin alhainen ja sen höyrynpaine on erittäin korkea.
Hiilidisulfidi on erittäin syttyvä. Hänen höyrynsä ovat erittäin helposti tulehtuneet, jopa sähköisen lampun lämmöllä. Tämä tarkoittaa, että se reagoi hapen kanssa nopeasti:
CS2 + 3 o2 → CO2 + 2 niin2
Se tosiasia, että sinulla on korkea höyrynpaine huoneenlämpötilassa, on vaarallista olla lähellä liekkiä.
Hajoamiseen lämmitettyä voi helposti hyödyntää, myrkyllisten kaasujen lähettäminen rikosoksideista. Yli 90 ° C: n yläpuolella se kytketään päälle spontaanisti.
Se hajoaa, kun sitä tallennetaan pitkään. Hyökkää kuparia ja sen seoksia. Se reagoi myös joitain muoveja, kumia ja pinnoitteita.
Reagoi tietyissä olosuhteissa veden kanssa muodostaen OCS -karbonyylisulfidin, hiilidioksidin Co2 ja vetydisulfidi H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 h2O → CO2 + 2 h2S
Alkoholilla (ROH) emäksisessä väliaineessa muodostaa xantateja (Ro-CS-NNA):
CS2 + ROH + NaOH → H2Tai + ro -c (= s) -sna
Saada
Hiilidisulfidi valmistetaan kaupallisesti rikkireaktiolla hiilen kanssa. Prosessi suoritetaan lämpötiloissa 750-900 ° C.
C + 2 S → CS2
Hiilen sijasta voit käyttää myös metaania tai maakaasua, ja jopa etaania, propaania ja propeenia on käytetty, jolloin reaktio tapahtuu 400-700 ° C: ssa korkean suorituskyvyn kanssa.
Se voidaan valmistaa myös reagoimalla maakaasua rikkivetyllä H2S erittäin korkea lämpötila.
Läsnäolo luonnossa
CS2 Se on luonnollinen tuote, joka on läsnä ilmakehässä hyvin pieninä määrinä (jäljet). Se esiintyy fotokemiallisesti pintavesillä.
Auringonvalon vaikutus tietyissä merivedessä olevissa yhdisteissä, kuten kysteiini (aminohappo) johtaa hiilidisulfidin muodostumiseen.
 Hiilidisulfid. Kirjoittaja: Pexels. Lähde: Pixabay.
Hiilidisulfid. Kirjoittaja: Pexels. Lähde: Pixabay. Se vapautuu luonnollisesti myös vulkaanisten purkausten aikana ja sitä löytyy pieninä määrinä suiden yli.
Voi palvella sinua: bentsaldehydiYleensä olemme alttiina hengittämään hyvin pieniä mittasuhteita ja sitä on läsnä joissain ruoissa. Sitä löytyy myös savukkeiden savusta.
Ympäristössä se hajoaa auringonvalon kautta. Maassa se liikkuu sen läpi. Jotkut maaperän mikro -organismit hajoavat.
Sovellukset
Kemianteollisuudessa
Hiilidisulfidi on tärkeä kemiallinen yhdiste, koska se auttaa valmistamaan muita kemikaaleja. Voi toimia kemiallisena välittäjänä.
Sitä käytetään myös prosessiliuottimena, esimerkiksi fosforin, rikin, seleenin, bromin, jodin, rasvojen, hartsien, vahojen, lakkien ja kumien liuottamiseksi.
Mahdollistaa mm. Lääketuotteiden ja rikkakasvien torjunta -aineiden valmistuksen.
Rayónin ja Celofánin tuotannossa
CS: n kanssa2 Valmistetaan Xantotos, jotka ovat Rayónin ja Celofánin valmistuksessa käytettyjä yhdisteitä.
Keinotekoisen silkin tai Rayonin saamiseksi se perustuu selluloosaan, jota käsitellään alkali- ja hiilidisulfidilla CS2 ja muuttuu selluloosan kekseliksi, liukoinen alkaliin. Tämä ratkaisu on viskoosista, ja siksi sitä kutsutaan "viscosaksi".
Viskoosi tehdään paineessa hyvin pienten reikien läpi happohuteen sisällä. Tässä selluloosa Xantate muuttuu jälleen selluloosaan, joka on liukenematon ja pitkät ja kirkkaat langat muodostuvat.
Kierteitä tai filamentteja voidaan kehrätä, jotta saadaan Rayón -niminen materiaali.
(1) Selluloosa + NaOH → alkalikelulosa
ROH + NaOH → Rona
(2) Alkaliluloosa + hiilidisulfidi → selluloosa Xantate
Rona + s = c = s → ro -c (= s) -sna
(3) selluloosan + happo → selluloosa (filamentit) xantaaatti (filamentit)
Ro -C (= S) -SNA + Happo → ROH
 Rayonista valmistetut vaatteet, joiden valmistus osallistuu hiilidisulfidiin. Tobias "ota" Maier [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Rayonista valmistetut vaatteet, joiden valmistus osallistuu hiilidisulfidiin. Tobias "ota" Maier [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Jos selluloosa saostuu kuljettamalla ksantato kapean raon läpi, selluloosa uudistetaan ohuiden arkkien muodossa, jotka muodostavat sellofaanin. Tämä on pehmennetty glyserolilla ja sitä käytetään esineen suojakalvona.
 Sellofaani valmistetaan hiilidisulfidin avulla. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay.
Sellofaani valmistetaan hiilidisulfidin avulla. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay. Hiilitetrakloridin tuotannossa
Hiilidisulfidi reagoi kloorin CL: n kanssa2 Antaa hiilitetrakloridi CCL4, mikä on tärkeä liuotin, joka ei ole polttoainetta.
Voi palvella sinua: kloorobentseeni (C6H5CL)CS2 + 3 Cl2 → CCL4 + S2Cl2
Useissa sovelluksissa
Hiilidisulfidi osallistuu kumin kylmään vulkanoitumiseen.
CS: llä valmistetut Xantotos2 Niitä käytetään mineraalien vaahdotuksessa.
Vanhat käyttötarkoitukset
CS2 Se on myrkky eläville organismeille. Aikaisemmin sitä käytettiin tuholaisten, kuten rottien, marmoottien ja muurahaisten tuhoamiseen, kaataen nesteen jokaisessa suljetussa tilassa, jossa nämä eläimet asuivat (urat ja hormigueros)).
Kun tiheitä myrkyllisiä höyryjä käytettiin tähän tarkoitukseen, he lopettivat jokaisen elävän organismin, joka oli suljetussa tilassa.
Sitä käytettiin myös eläimille antihelmintisenä ja toukkien poistamiseksi moskoronista hevosten vatsasta.
Maataloudessa sitä käytettiin hyönteismyrkkynä ja nemaattina, maaperän haisemiseen, lastentarhojen, latojen, siilojen ja viljamyllyjen torjumiseen. Rautatievautot, alukset ja proomut olivat myös.
 Viljelijä vuonna 1904 maaperän polttaminen hiilidisulfidilla rypälekasvien ruttoa torjumiseksi. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.GNU.Org/lisenssit/vanhojen lisenssit/FDL-1.2.HTML)]. Lähde: Wikimedia Commons.
Viljelijä vuonna 1904 maaperän polttaminen hiilidisulfidilla rypälekasvien ruttoa torjumiseksi. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.GNU.Org/lisenssit/vanhojen lisenssit/FDL-1.2.HTML)]. Lähde: Wikimedia Commons. Kaikki nämä käytöt olivat kiellettyjä CS: n korkean syttyvyyden ja toksisuuden vuoksi2.
Riskejä
CS2 Se on erittäin syttyvä. Monet reaktiosi voivat aiheuttaa tulen tai räjähdyksen. Höyrynsä sekoitukset ilmalla ovat räjähtäviä. Kun tulehdus tuottaa ärsyttäviä tai myrkyllisiä kaasuja.
Viemärien hiilidisulfidia ei tule kaataa, koska putkissa on CS -seos2 ja ilma, joka voi aiheuttaa räjähdyksen, jos se on vahingossa.
Hänen höyrynsä ampuvat spontaanisti yhteydessä kipinöihin tai kuumiin pintoihin.
Hiilidisulfidi ärsyttää vakavasti silmiä, ihoa ja limakalvoja.
Jos keskushermosto hengitetään tai nielee vakavasti, sydän- ja verisuonijärjestelmä, silmät, munuaiset ja maksa. Se voidaan myös imeytyä ihon läpi aiheuttaen vaurioita.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2020). Disulfidihiili. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Mopper, k. Ja Kieber, D.J -. (2002). Valokemia ja hiilen, rikin, typen ja pospheruksen pyöräily. Meren liuenneen orgaanisen aineen biogeokemiaisuus. ScienEdirect.com.
- Meyer, b. (1977). Rikin ja sen komplien teollisuuskäyttö. Disulfidihiili. Rikkiä, energiaa ja kateutta. ScienEdirect.com.
- Pohanish, r.P. (2012). C. Disulfidihiili. Sittigin myrkyllisten ja vaarallisten kemikaalien ja karsinogeenien käsikirjassa (kuudes painos). ScienEdirect.com.
- Morrison, r.T. ja Boyd, R.N. (2002). Orgaaninen kemia. 6. painos. Prentice-sali.
- Windholz, m. et al. (Toimittajat) (1983). Merck -indeksi. Kemikaalien, lääkkeiden ja biologisten enyclopedia. Kymmenes painos. Merck & Co., Inc.
- « Katolisten pyhien 95 parasta lausetta
- +105 Katoliset lauseet uskosta, pohdinnasta, rukouksesta ja toivosta »

