Klooridioksidirakenne (CLO2) -rakenne, käyttää, saada, riskit, ominaisuudet

- 3247
- 705
- Sheldon Kuhn
Hän klooridioksidi Se on epäorgaaninen yhdiste, jonka muodostaa kloorielementti (CL) ja happi (O). Sen kemiallinen kaava on CLO2. Se on vihertävää punertavan keltaista kaasua. Sitä ei luonnollisesti löydy ympäristöstä.
Se on erittäin reaktiivinen, joten on yleistä, että se valmistuu paikassa, jossa sitä käytetään. Yksi sen tärkeimmistä käytöistä on mikrobidi, antiseptinen ja deodorisointi, koska se eliminoi bakteerit, virukset ja sienet erittäin helposti ja erittäin alhaisina pitoisuuksina.
 Jotkut supermarketeissa myytävät elintarvikkeet ovat saattaneet olla desinfioituna klooridioksidilla2. Kirjoittaja: ElasticComputEfarm. Lähde: Pixabay.
Jotkut supermarketeissa myytävät elintarvikkeet ovat saattaneet olla desinfioituna klooridioksidilla2. Kirjoittaja: ElasticComputEfarm. Lähde: Pixabay. Se mahdollistaa ruokia, kuten vihanneksia, hedelmiä, lihaa, lintuja ja äyriäisiä. Se palvelee pintojen, lattian, kylpyhuoneiden, ilmanvaihtojärjestelmien, uima -altaiden, laboratoriolaitteet, hammaslääkärilaitteet jne.
Siksi sitä käytetään elintarvikkeiden jalostuksessa, sairaaloissa ja klinikoilla, teollisuudessa ja kaupoissa. Sitä käytetään juomiseen käytetyn veden puhdistamiseen ja myös kuntien jäteveteen.
Se on erittäin tehokas hapettavana aineena, joten sitä käytetään valkaisuaineiden massa, öljyt, jauhot, nahka, tekstiilikuituja, muun muassa.
Kun se on kaasun muodossa, se on erittäin vaarallinen, koska se on erittäin räjähtävä ja sitä käytetään pääasiassa vesiliuoksissa. Se on myrkyllistä, jos se hengittää.
[TOC]
Rakenne
Klooridioksidi muodostuu klooriatomin (CL) yhdistämällä kahdella happiatomilla (O) (O). Kloorilinkit jokaiseen happea ovat kovalenttisia ja kaksinkertaisia. Tämän yhdisteen kloorin valenssi on +4.
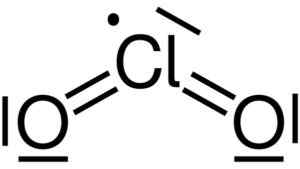 Klooridioksidin Lewis -rakenne2. Yikrazuul [julkinen alue]. Lähde: Wikimedia Commons.
Klooridioksidin Lewis -rakenne2. Yikrazuul [julkinen alue]. Lähde: Wikimedia Commons. Sillä on symmetrinen ja kulma -muotoinen rakenne, koska siinä on vapaat elektronit. Eli ne eivät muodosta yhteyttä mihinkään muuhun atomiin.
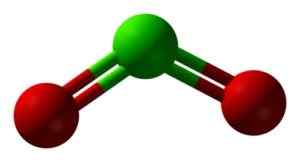 CLO -rakenne2 kolmiulotteisesti. Vihreä = kloori; Punainen = happi. Ben Mills ja Jynto [julkinen alue]. Lähde: Wikimedia Commons.
CLO -rakenne2 kolmiulotteisesti. Vihreä = kloori; Punainen = happi. Ben Mills ja Jynto [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Klooridioksidi
- Kloorioksidi (IV)
Ominaisuudet
Fyysinen tila
Vihertävä keltainen punertavan keltainen kaasu.
Molekyylipaino
67,45 g/mol.
Sulamispiste
-59 ºC.
Kiehumispiste
11 ºC.
Tiheys
Neste 0 ° C: ssa = 1 642 g/cm3
Kaasu = 2,33 (ilman suhteellinen tiheys, ilma = 1).
Se voi palvella sinua: isoamyylialkoholi: rakenne, ominaisuudet, käytöt ja riskitLiukoisuus
Vesiliukoinen: 2000 cm3 luona2 Kaasu 100 cm3 kylmää vettä tai 0,8 g/100 ml vettä 20 ° C: ssa. Liukoinen alkaliseen liuokseen ja rikkihappoliuokseen H2Sw4.
Kemialliset ominaisuudet
Clo2 Se on erittäin reaktiivinen ja voi hyödyntää väkivaltaisesti. Se on erittäin tehokas hapettua ainetta.
Clo2 Se rikkoutuu väkivaltaisesti, jos se joutuu kosketuksiin orgaanisten materiaalien kanssa. Jos olet ilmassa yli 10%: n pitoisuudessa, se voi räjähtää auringonvalon tai lämmön takia.
Voit myös räjäyttää elohopean (HG) tai hiilimonoksidin (CO) läsnä ollessa.
Ultravioletin (UV) tai otsonin mukaan Clo2 Siitä tulee klooriheksoksidia2JOMPIKUMPI6, erittäin epävakaa yhdiste.
Vesipitoisten ratkaisujen ominaisuudet
Hänen vesipitoiset liuokset ovat keltaisia tai punertavia. Ne ovat vakaita, jos ne pysyvät kylminä, hyvin suljettuina ja suojattuna auringonvalolta. Valon läsnä ollessa nämä liuokset hajotetaan hitaasti, jotta HCL -suolahappo ja hclo -kloorihappo3.
 Clo -vesiliuos2 missä havaitaan, että keltainen kaasu vapautuu, joka on CLO2. Kirjoittaja: Materialscientist. Lähde: Wikimedia Commons.
Clo -vesiliuos2 missä havaitaan, että keltainen kaasu vapautuu, joka on CLO2. Kirjoittaja: Materialscientist. Lähde: Wikimedia Commons. Alkalisissa ratkaisuissa CLO2 Se on jaoteltu ionien kloriitti -cloon2- ja clorty3-. Happoliuoksissa kloorihappo muodostaa HCLO: n2 Ja sitten tämä hajoaa HCL -suolahapoksi ja hclo -kloorihapoksi3.
Muut ominaisuudet
CLO: n keskittyneet höyryt2 Ne ovat potentiaalisesti räjähtäviä, joten ei ole ollut mahdollista puristaa kumpaakaan vain sekoitettuna muihin kaasuihin. Tästä syystä on suositeltavaa valmistella sitä sivustolla, jossa sitä käytetään.
Kun se on hyvin matala lämpötilat sen hydratoidussa muodossa, mikä on tapa, jolla se joskus siirretään, se on kiinteä jään kaltaisen lohkon ja oranssin muodossa.
Siinä on kaltainen haju kuin kloori. On myrkyllistä hengittämällä.
Saada
Voidaan saada monin tavoin. Esimerkiksi joissain tapauksissa CLO -ratkaisut2 Ne valmistautuvat ohittamaan kloorikaasun seoksen (Cl2) ja ilma (tai kloori- ja typpikaasu2) pylvään kautta, joka sisältää natriumkloriittirakeita (Naclo2-A.
Voi palvella sinua: Valencia -kerros2 naclo2 + Cl2 → 2 NaCl + 2 Clo2
Luotu tuote sisältää noin 90% CLO: ta2, Muun muassa klooriyhdisteiden joukossa.
Se saadaan myös kaliumkloraatista (kclo3) ja rikkihappo (H2Sw4) Oksaalihapon läsnä ollessa pelkistimenä. Tässä tapauksessa muodostuu myös hiilidioksidia (CO2) se aikoo laimentaa CLO: ta2.
Se voidaan valmistaa käyttöpaikalla natriumkloraatin perusteella (Naclo3), rikkihappo (H2Sw4) ja metanoli (valitse3VAI NIIN).
Teollisuudessa se saa natriumkloraatin (Naclo3) ja rikkidioksidi (niin2) Rikkihapon läsnä ollessa.
2 naclo3 + Sw2 + H2Sw4 → 2 CLO2 + 2 NAHSO4
Käyttää desinfiointiainetta
Sitä voidaan käyttää voimakkaana antimikrobisena aineena. On havaittu, että se on erittäin tehokas useita mikro -organismeja, kuten Escherichia coli ja Staphylococcus aureus.
Jälkimmäisen kanssa vain 5 ppm CLO: ta2 Poista 100% heistä. Se on bakteereja tappavia, antiseptisiä ja deodorisoivia. Se on tehokas laajalla pH -aikavälillä.
Ruokia
Sitä käytetään antimikrobisena aineena vedessä hedelmien ja vihannesten haisemiseen lintujen lintujen, punaisten lihojen, sekä lihapalojen sekä merituotteiden ja merenelävien jalostuksessa.
 Supermarkettien punainen liha on ehkä käsitelty klooridioksidilla niiden desinfioimiseksi. Kirjoittaja: Karamo. Lähde: Pixabay.
Supermarkettien punainen liha on ehkä käsitelty klooridioksidilla niiden desinfioimiseksi. Kirjoittaja: Karamo. Lähde: Pixabay. Klooridioksidiliuoksia tulisi käyttää pitoisuudessa, joka ei ylitä 3 ppm (osapuolet miljoonaa) CLO: ta2 jäännös, niin että sillä ei ole vaikutusta ruokaan.
CLO: n hoidon jälkeen2 Kaikkia ruokia on hallita kokonaan juomaveden kanssa tai niitä on käytettävä kaltevuutena, keittämällä tai purkitettuna.
Merituotteiden tapauksessa viemäriliuos2 Sitä tulisi käyttää vedessä ja jäällä, joita käytetään huuhtelussa, pesussa, sulatuksessa, kuljetuksessa tai varastoinnissa. Raaka meren antimet on sitten pestävä erittäin hyvin juomavedellä ennen kulutusta.
 Kylmä vesi ja jää, jolla meri hedelmät sisältävät pieniä määriä CLO: ta2. Kirjailija: Public Domainpartures. Lähde: Pixabay.
Kylmä vesi ja jää, jolla meri hedelmät sisältävät pieniä määriä CLO: ta2. Kirjailija: Public Domainpartures. Lähde: Pixabay. Paperilla ja pahvilla, jotka joutuvat kosketuksiin ruoan kanssa
Clo Solutions2 Niitä käytetään eliminoimaan mikro -organismeja, jotka aiheuttavat ohutta (kuten levät, bakteerit ja sienet) prosessivedessä, jota käytetään paperin ja pahvin valmistuksessa, jotka joutuvat kosketuksiin ruoan kanssa.
Voi palvella sinua: apolarimolekyylitJuomavedessä
Se puhdistaa veden ja tekee siitä juomakelpoisen (turvallinen juoda). Sitä käytetään veden esikäsittelyssä, joka sitten pullotetaan juomaan tai vettä, jota käytetään ainesosana juomien tai virvoitusjuomien valmistuksessa.
 Jotkut jalostetut virvoitusjuomat voivat sisältää käsiteltyä vettä CLO: lla2. Susan Slater [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Jotkut jalostetut virvoitusjuomat voivat sisältää käsiteltyä vettä CLO: lla2. Susan Slater [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Hammaslääketieteessä
Sitä käytetään hammaslääkärin tai hammaslääkärin käyttämiin instrumentteihin desinfioida ne ja tuhota patogeeni -organismit.
Lääketieteellisissä sovelluksissa
Clo -vesiliuokset2 Niitä on käytetty oraalisen kandidiaasin hoitamiseen (suuinfektio). Kandidiaasi on sieni -infektio Candida albicans.
 Candida albicans -sienen esiintyminen laboratoriosakassa. CDC/DR. William Kaplan [julkinen alue]. Lähde: Wikimedia Commons.
Candida albicans -sienen esiintyminen laboratoriosakassa. CDC/DR. William Kaplan [julkinen alue]. Lähde: Wikimedia Commons. Klooridioksidi eliminoi suun suusta ja parantaa merkittävästi oraalikudosten ulkonäköä ilman sivuvaikutuksia.
Jotkut lääketieteelliset tutkijat osoittavat, että CLO -ratkaisut2 Kirurgisten operaatioiden haavoihin sovellettuja ne voivat vähentää tai tukahduttaa liittymisten muodostumisen vaikuttamatta sen parantamiseen, ja sen antiseptisten ominaisuuksien lisäetu.
Muut käyttötarkoitukset
CLO: n hapettavien ja mikrobisidisten ominaisuuksien suhteen2 käytetään:
- Valkaisua puun selluloosa massan ja paperin valmistuksessa tarjoamalla vakaan kiilto.
- Koristele rasvoja ja öljyjä, nahkaa, valkaista jauhoja ja tekstiilejä.
- Maatalouden sovellukset, kuten kovien pintojen, laitteiden, vesijärjestelmien ja sienten kasvihuoneiden desinfiointi.
- Sovellukset teollisuudessa, kaupoissa ja sairaaloissa, kuten kovien pintojen desinfiointi (seinät, lattiat, kylpyhuone), ilmanvaihtojärjestelmät, laboratoriolaitteet.
- Desinfiointi asunnot ja kotitalouksien, ilmastointijärjestelmät, uimaveden kiertojärjestelmät.
- Kunnallisen ja teollisuuden jäteveden hoito.
- Öljykenttien pilaantumisen puhdistus.
- Kloridisuolojen valmistus (CL--A.
Riskejä
- CLO: n keskittyneet höyryt2 Ne ovat potentiaalisesti räjähtäviä.
- Se on myrkyllistä hengittämällä ja nauttimisella. Se on ärsyttävä silmä, nenä ja kurkku, voi aiheuttaa keuhkojen turvotusta ja kroonista keuhkoputkentulehdusta.
- Lähteiden mukaan CLO: ta kuulivat2 ei aiheuta DNA -mutaatioita tai aiheuta syöpää ihmisillä.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Klooridioksidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Dean, J.-Lla. (Toimittaja). (1973). Langen kemian käsikirja (yhdestoista painos). McGraw-Hill Book Company.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Vch verlagsgellschaft mbh.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Bajpai, P. (2012). Klooridioksidivalkaisu. Klooridioksidin valkaisun vaikutus massan laatuun. Ympäristössä hyvänlaatuisissa lähestymistapoissa massan valkaisuun (toinen painos). ScienEdirect.com.
- Moran, S. (2018). Vesikemia. Klooridioksidi. Sovellettuun oppaaseen vesi- ja jätevesien käsittelylaitoksen suunnitteluun. ScienEdirect.com.
- McKen, L. (2012). Johdatus ruoka- ja lääketieteelliseen sterilointiin. Kaasusolo. Steriloinnin vaikutus muoveihin ja elastomeereihin (kolmas painos). ScienEdirect.com.
- « Ylempi paleoliittiset ominaisuudet, taide, sosiaalinen organisaatio
- Sulfonihapporakenne, nimikkeistö, ominaisuudet, käyttää »

