Kemialliset yhtälöosat ja esimerkit
- 1667
- 289
- Edgar VonRueden
Se Kemiallinen yhtälö Se on kaavamainen esitys joillekin kemiallisen reaktion ominaisuuksista. Voidaan myös sanoa, että kemiallinen yhtälö kuvaa reaktioon osallistuvien eri aineiden kokemat muutokset.
Kemiallisessa yhtälössä sijoitetaan eri osallistuvien aineiden kaavat ja symbolit, jotka osoittavat selvästi yhdisteissä läsnä olevien elementtien atomien lukumäärän, joka näkyy alaindeksiä ja jota ei voida muuttaa yhtälön tasapainottaessa.
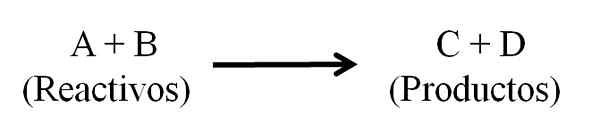
 Kemiallisen reaktion yleinen kemiallinen yhtälö. Reagenssit ja tuotteet. Lähde: Gabriel Bolívar.
Kemiallisen reaktion yleinen kemiallinen yhtälö. Reagenssit ja tuotteet. Lähde: Gabriel Bolívar. Kemiallisen yhtälön on oltava tasapainossa, toisin sanoen sekä reagenssien että tuotteiden atomien lukumäärän on oltava samoja. Tällä tavalla aineen säilyttämisen lakia noudatetaan. On toivottavaa, että yhtälöiden tasapainottamiseen käytetyt numerot ovat kokonaisia numeroita.
Nämä yhtälöt eivät paljasta peräkkäisiä vaiheita tai miksi mekanismit reagenssit muuttuvat tuotteiksi.
Siksi vaikka ne ovat erittäin hyödyllisiä ymmärtääkseen, mihin kemiallinen reaktio menee, se ei salli ymmärtää sen molekyylinäkökohtia tai miten tietyt muuttujat vaikuttavat niihin; kuten pH, viskositeetti, reaktioaika, levottomuuden nopeus.
[TOC]
Kemiallisen yhtälön osat
Pohjimmiltaan kemiallisessa yhtälössä on kolme pääosaa: reagenssit, tuotteet ja nuolet, jotka osoittavat kemiallisen reaktion merkityksen.
Reagenssien ja tuotteiden sijainti
Kemiallisessa yhtälössä kaikki aineet, jotka toimivat reagenssina ja kaikki tuotteet, ilmestyvät. Nämä ainesryhmät erotetaan nuolella, joka osoittaa reaktion merkityksen. Reagenssit sijaitsevat nuolen vasemmalla puolella ja oikealla olevat tuotteet.
Nuoli tarkoittaa sitä, mitä tuotetaan ja on suunnattu vasemmalta oikealle (→), vaikka palautuvissa reaktioissa on kaksi vastaavaa ja yhdensuuntaista nuolta; yksi suunnattu oikealle ja toinen vasemmalle. Symboli (δ) asetetaan yleensä nuoleen, mikä osoittaa, että reaktiossa käytettiin lämpöä.
Voi palvella sinua: terpenosLisäksi katalyytin tunnistaminen asetetaan yleensä nuolelle, jos mahdollista sen kaavalla tai symbolilla. Erilaiset aineet, jotka ilmestyvät reagensseina, erotetaan merkinnällä (+), mikä osoittaa, että aineet reagoivat tai yhdistyvät keskenään.
Tuotteina esiintyvien aineiden tapauksessa Sign (+): lla ei ole aikaisempaa merkitystä; ellei reaktiota palautettava. On kätevää, että merkki (+) on sijoitettu yhtä kaukana olevista aineista, jotka erottuvat.
Kemiallisten yhtälöiden tasapaino
Se on välttämätön vaatimus, että kemialliset yhtälöt ovat tasapainossa oikein. Tätä varten asetetaan lukumäärä stoikiometrinen kerroin. Aina tarvittaessa tämän kerroksen on mentävä reagenssina tai tuotteina esiintyvien aineiden edessä.
Tämä on niin varmistaa, että reagenssina esiintyvien elementtien kaikkien atomien lukumäärä on täsmälleen yhtä suuri kuin niiden lukumäärä, joka ilmestyy tuotteeseen. Yksinkertaisin kemialliset yhtälöiden menetelmä on Tanteo.
Kemiallisen yhtälön komponenttien fysikaaliset tilat
Joissakin kemiallisissa yhtälöissä aineiden fysikaalinen tila on merkitty alateollisuudella. Tätä varten seuraavia lyhenteitä käytetään espanjaksi: (s) kiinteä tilassa; l) nestemäiselle tilalle; (g), kaasumainen tila; ja (AC), vesiliuos.
Esimerkki: Kalsiumkarbonaattireaktio suolahapon kanssa.
Varas3 (s) + 2 HCL(AC) → CACl2 (s) + H2JOMPIKUMPI(L) + Yhteistyö2 g)
Fyysisen tilan muutokset
Joissakin tapauksissa se on merkitty kemiallisessa yhtälössä, jos kemiallisessa reaktiossa on kaasua tuotettua kaasua tai jos tuotetut aineet saostuvat.
Voi palvella sinua: binaarisuolatKaasun läsnäolo on merkitty pystysuoralla nuolella, jonka pää on suunnattu ylöspäin (↑), joka on asetettu kaasumaisen aineen oikealle puolelle.
Esimerkki: Sinkkireaktio suolahapon kanssa.
Zn +2 HCL → Zncl2 + H2↑
Jos kemiallisessa reaktiossa yksi aineista muodostaa sakan, sitä symboloidaan asettamalla pystysuuntainen nuoli, jonka pää on suunnattu (↓), asetettu saostetun aineen oikealle puolelle.
Esimerkki: suolahapporeaktio hopea -nitraatin kanssa.
HCL + Agno3 → HNO3 + AGCL ↓
Esimerkki kemiallisista yhtälöistä
- Fotosynteesi
 Fotosynteesiyhtälö
Fotosynteesiyhtälö Fotosynteesi on prosessi, jolla kasvit vangitsevat ja muuttavat valoenergiaa auringonvalosta, jotta saadaan käyttöön heidän toimeentuloaan tarvittava energia. Fotosynteesin suorittavat organelit, jotka ovat tyypillisiä kasvisoluille, joita kutsutaan kloroplastiiksi.
Kloroplastikalvossa ovat talkoideja, paikkoja, joissa löytyy klorofylejä -lla ja b -, jotka ovat tärkeimmät pigmentit, jotka vangitsevat valon energiaa.
Vaikka fotosynteesi on monimutkainen prosessi, se voidaan kaavioida seuraavassa kemiallisessa yhtälössä:
6 CO2 + 6 h2O → c6H12JOMPIKUMPI6 + 6 o2↑ ΔGº = 2.870 kJ/mol
C6H12JOMPIKUMPI6 Se on glukoosin, metaboloidun hiilihydraatin kaava ATP: n tuottamiseksi; Yhdiste, joka on tärkein energiasäiliö useimmissa elävissä olennoissa. Lisäksi glukoosin NADPH: sta syntyy koentsyymiä, jota tarvitaan lukuisiin reaktioihin.
- Solujen hengitys
Solut käyttävät happea nieltyissä elintarvikkeissa olevien lukuisten aineiden aineenvaihduntaan. Samaan aikaan ATP: tä käytetään elossa olevien olentojen suorittamien aktiviteettien energialähteenä, tuottaen näissä prosesseissa dioksidihiili ja vesi.
Voi palvella sinua: alumiiniasetaatti (Al (CH3COO) 3): rakenne, ominaisuudet, käyttötarkoituksetJos glukoosia käytetään metaboloiduna ainemallina, hengitys voidaan muotoilla seuraavalla kemiallisella yhtälöllä:
C6H12JOMPIKUMPI6 + 6 o2 → 6 Co2 + 6 h2JOMPIKUMPI
- Yleiset elementit reaktiot
Hajotusreaktio
Yhdiste tai yhdisteet dissosioituu (n), joka muodostuu sen atomien kanssa, muut eri yhdisteet:
2 kclo3 (s) → 2 KCl(S) + 3 o2 g)
Siirtymäreaktio
Metalli reagoi yhdisteellä, joka korvaa tässä läsnä olevan metallin:
Mg(S) + Cuso4 (AC) → Cu(S) + Mgso4 (AC)
Eliminointireaktio
Tämän tyyppisessä reaktiossa hiiliatomiin kiinnitettyjen atomien tai ryhmien lukumäärä:
CH3-CH2Br +naoh → h2C = ch2 + H2O +nabr
Kosteusreaktio
Se on reaktio, jossa yhdiste lisää vesimolekyylin. Tämä reaktio on tärkeä alkoholien valmistuksessa:
H2C = ch2 + H2O → h2C-C-CH2vai niin
Neutralointireaktio
Pohja tai alkali reagoi hapon kanssa, joka tuottaa suolaa ja vettä:
HCL(AC) + Naoh(AC) → NaCl(AC) + H2JOMPIKUMPI(L)
Synteesireaktio
Tämän tyyppisessä reaktiossa kaksi tai useampia aineita yhdistetään uuden yhdisteen aiheuttamiseksi:
2 li(S) + Cl2 g) → 2 LICL(S)
Kaksinkertainen siirtymäreaktio (metateesi)
Tämän tyyppisessä reaktiossa on positiivisten ja negatiivisten ionien vaihtaminen uusien yhdisteiden muodostamiseksi:
Agno3 (AC) + NaCl(AC) → AgCl(S) + Vanhempi veli3 (AC)
Viitteet
- Kukkia, j. (2002). Kemia. Painos 1was. Santillana -toimitus
- Mathews, c. K -k -., Van Holde, K. JA., Ja ahern, k. G. (2002). Biokemia. 3was Painos. Pearson Addison Wesley toimitus
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2019). Kemiallinen yhtälö. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (20. syyskuuta 2019). Mikä on kemiallinen yhtälö? Toipunut: Admingco.com
- « Molaarinen tilavuuskonsepti ja kaava, laskenta ja esimerkit
- Challenger Abyss Geologinen muodostuminen, sijainti, ominaisuudet »

