Molaarinen tilavuuskonsepti ja kaava, laskenta ja esimerkit
- 4732
- 1427
- Arthur Terry II
Hän molaarinen tilavuus Se on intensiivinen ominaisuus, joka osoittaa, kuinka paljon tilaa määrityksen tai yhdisteen mooli miehittää. Edustaa symbolia Vm, ja ilmaistaan DM -yksiköissä3/mol kaasuille ja cm3/Mol nesteille ja kiinteille aineille, koska jälkimmäiset rajoittuvat enemmän niiden suurimpiin molekyylien välisiin voimiin.
Tämä ominaisuus toistuu tutkiessaan termodynaamisia järjestelmiä, joihin liittyy kaasuja; koska nesteiden ja kiinteiden aineiden osalta yhtälöt määrittävät Vm Heistä tulee monimutkaisempia ja epätarkempia. Siksi peruskurssien suhteen molaarinen tilavuus liittyy aina ihanteelliseen kaasuteoriaan.
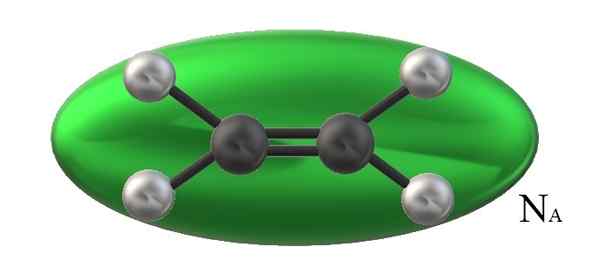
 Eteenimolekyylin tilavuutta rajoittaa pinnallisesti vihreä ellipsoidi ja Avogadro -aikojen lukumäärä tämä määrä. Lähde: Gabriel Bolívar.
Eteenimolekyylin tilavuutta rajoittaa pinnallisesti vihreä ellipsoidi ja Avogadro -aikojen lukumäärä tämä määrä. Lähde: Gabriel Bolívar. Tämä johtuu siitä, että ihanteellisissa tai täydellisissä kaasuissa rakenteellisilla näkökohdilla ei ole merkitystä; Kaikki sen hiukkaset visualisoidaan palloiksi, jotka törmäävät elastisesti keskenään ja käyttäytyvät samalla tavalla riippumatta siitä, mitkä niiden massansa tai ominaisuudet ovat.
Siten yksi ihanteellisen kaasun mooli miehittää tietyssä paineessa ja lämpötilassa samalla tilavuudella Vm. Sanotaan. Tämä arvo on hyödyllinen ja likimääräinen, vaikka todelliset kaasut arvioidaan.
[TOC]
Käsite ja kaava
Kaasuihin
Välitön kaava lajin molaarisen määrän laskemiseksi on:
Vm = V/n
Missä v on sen käyttämä tilavuus ja n Lajien määrä moolissa. Ongelmana on, että vm Se riippuu molekyylien kokemasta paineesta ja lämpötilasta, ja matemaattisen ekspression halutaan ottaa nämä muuttujat huomioon.
Voi palvella sinua: molealiteettiKuvan etyleeni, h2C = ch2, Siinä on molekyylitilavuus, johon liittyy vihreä ellipsoidi. Tämä h2C = ch2 Se voi pyöriä monin tavoin, mikä on kuin se, että se liikkui tilassa, sanoi ellipsoidia visualisoidakseen kuinka paljon äänenvoimakkuutta se miehittää (ilmeisesti halveksittava).
Kuitenkin, jos tällaisen vihreän ellipsoidin tilavuus kertoo sen n-Lla, Avogadro -numerossa on sitten mooli eteenimolekyylejä; Yksi mol ellipsoidia vuorovaikutuksessa toistensa kanssa. Korkeammassa lämpötilassa molekyylit erottuvat toisistaan; Vaikka ne ovat suuressa paineessa, he supistuvat ja vähentävät määränsä.
Siksi vm on riippuvainen p: stä ja t: stä. Etyleeni on tasainen geometria, joten ei voida ajatella, että sen Vm Ole tarkka ja täsmälleen sama kuin metaani, Cho4, tetraedrinen geometria ja kykenevä edustamaan palloa eikä ellipsoidia.
Nesteille ja kiinteille aineille
Nesteiden ja kiinteiden aineiden molekyyleillä tai atomilla on myös oma Vm, joka voi liittyä tiheyteen:
Vm = m/(d · n)
Lämpötila vaikuttaa molaaritilavuuteen enemmän nesteissä ja kiinteissä aineissa kuin paine, kunhan jälkimmäinen ei vaihtele voimakkaasti tai kohtuuttomia (GPA: n luokassa). Samoin, kuten etyleenillä mainittiin, geometriat ja molekyylirakenteet vaikuttavat suuresti V: n arvoihinm.
Normaaliolosuhteissa havaitaan kuitenkin, että eri nesteiden tai kiinteiden aineiden tiheydet eivät vaihtele liikaa niiden voimakkuutta; Sama koskee sen molaarisia määriä. Huomaa, että tiheimmät ne ovat, alempi Vm.
Kiinteän aineesta sen molaarinen tilavuus riippuu myös sen kiteisistä rakenteista (sen yksikkösolun tilavuus).
Voi palvella sinua: kaliumbiftalaatti: rakenne, nimikkeistö, käyttö, riskitKuinka laskea molaarinen tilavuus?
Toisin kuin nesteet ja kiinteät aineet, ihanteellisissa kaasuissa on yhtälö, jonka avulla voit laskea Vm riippuen p ja t ja sen muutokset; Tämä on ihanteelliset kaasut:
P = nrt/v
Joka sopii ilmaisemaan V/n:
V/n = rt/p
Vm = Rt/p
Jos käytämme kaasuvakiota r = 0,082 l · atm · k-1· Mol-1, Sitten lämpötilat on ilmaistava Kelvinissä (K) ja ilmakehän paineet. Huomaa, että tässä havaitaan miksi vm Se on intensiivinen omaisuus: T: llä ja P ei ole mitään tekemistä kaasun massan kanssa, mutta sen tilavuudella.
Nämä laskelmat ovat päteviä vain olosuhteissa, joissa kaasut käyttäytyvät tiiviisti ihanteellisuuteen. Kokeilun kautta saatuilla arvoilla on kuitenkin pieni marginaali suhteessa teoreetikkoihin.
Molaarisen tilavuuden laskentaesimerkit
Esimerkki 1
Sinulla on kaasu ja jonka tiheys on 8,5,5 · 10-4 g/cm3. Jos sinulla on 16 grammaa, mikä vastaa 0,92 moolia y, laske molaarinen tilavuus.
Tiheyskaavasta voimme laskea, mikä tilavuus ja käyttää sellaisia 16 grammaa:
V = 16 g/ (8,5 · 10-4 g/cm3-A
= 18.823,52 cm3 tai 18,82 l
Niin vm Se lasketaan suoraan jakamalla tämä tilavuus annettujen moolien määrän välillä:
Vm = 18,82 l/0,92 mol
= 20,45 l/mol o l · mol-1 tai DM3· Mol-1
Harjoitus 2
Edellisessä esimerkissä ja sitä ei määritetty milloin tahansa, mikä oli mainitun kaasun hiukkaset, jotka olivat kokeneet. Olettaen, että se toimi ja ilmakehän paineessa ja siinä, laske sen puristamiseksi määritettyyn molaaritilavuuteen tarvittava lämpötila.
Voi palvella sinua: pakkauskerroinHarjoituslausunto on pidempi kuin sen päätöslauselma. Käännymme yhtälöön:
Vm = Rt/p
Mutta selvitämme t, ja tiedämme, että ilmakehän paine on 1 atm, ratkaisemme:
T = vmPR
= (20,45 l/mol) (1 atm)/(0,082 L · atm/k · mol)
= 249,39 K
Eli yksi mooli ja vie 20,45 litraa lämpötilassa, joka on lähellä -23,76 ºC.
Harjoitus 3
Yllä olevien tulosten jälkeen määritä Vm 0 ºC: ssa, 25 ° C ja absoluuttisessa nollassa ilmakehän paineessa.
Muuttaa lämpötilat Kelviniksi, meillä on ensimmäinen 273,17 K, 298,15 K ja 0 K. Ratkaisemme suoraan korvaamalla ensimmäisen ja toisen lämpötilan:
Vm = Rt/p
= (0,082 L · atm/ k · mol) (273,15 K)/ 1 atm
= 22,40 l/mol (0 ºC)
= (0,082 L · atm/ k · mol) (298,15 K)/ 1 atm
= 24,45 l/mol (25ºC)
Alussa mainittiin 22,4 litran arvo. Huomaa kuinka vm nousta lämpötilan kanssa. Kun haluat tehdä saman laskelman absoluuttisella nollalla, kompastumme termodynamiikan kolmanteen lakiin:
(0,082 L · atm/ k · mol) (0 K)/ 1 atm
= 0 l/mol (-273,15 ºC)
Kaasua eikä sillä ole olemassa olevaa molaarista tilavuutta; Tämä tarkoittaa, että siitä on tullut neste ja edellinen yhtälö ei ole enää voimassa.
Toisaalta V: n mahdottomuus V: n laskemiseenm Absoluuttisessa nolla ei noudata termodynamiikan kolmatta lakia, jonka mukaan mitään aineita on mahdotonta jäähdyttää absoluuttisen nollan lämpötilassa.
Viitteet
- Iranin. Levine. (2014). Fysikaalis -periaatteet. Kuudes painos. MC Graw Hill.
- Glassi. (1970). Fysikaaliset kemian sopimus. Toinen painos. Aguilar.
- Wikipedia. (2019). Molaarinen tilavuus. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (8. elokuuta 2019). Molaarisen tilavuuden määritelmä kemiassa. Toipunut: Admingco.com
- Byju. (2019). Molaarinen tilavuuskaava. Toipunut: byjus.com
- González Mónica. (28. lokakuuta 2010). Molaarinen tilavuus. Palautettu: kemia.Laguia2000.com

